УДК 619:616.98:578.824.11:615.371
DOI 10.33861/2071-8020-2019-3-7-9
Гусев А.А. АО «Покровский завод биопрепаратов», Владимирская область, пос. Вольгинский
Авилов В.М. Российская академия наук, г. Москва
Бабак В.А. филиал РГП «Национальный центр биотехнологии» в
г. Степногорске, Республика Казахстан, г. Степногорск
Пунтус И.А., Смаилова А.С. РНИДУП «Институт экспериментальной
ветеринарии имени С.Н. Вышелесского», Беларусь, г. Минск
Введение. Ветеринарные вакцины против бешенства содержат или живой вирус, аттенуированный для целевых животных (такой как Flury низкого пассажа на яйцах, Flury высокого пассажа на яйцах, Street-Alabama-Dufferin или Kelev), или вирус, инактивированный химическими или физическими средствами, или представляют из себя рекомбинантные генноинженерные вакцины. Вакцинный вирус культивируют в ткани ЦНС новорожденных животных (тканевые вакцины), в яйцах с развивающимся эмбрионом (эмбриональные) или в различных клеточных культурах (культуральные) [4, 5, 6]. Для каждого вида разрабатываемой вакцины, на животных-мишенях следует определить продолжительность и напряжённость иммунитета, выработанного в результате применения биопрепарата.
Относительно живых вирусных вакцин, должно быть установлено минимальное количество вируса, на введение которого вырабатывается адекватный иммунный ответ. Кроме того вакцины обоих типов подвергают тестированию на безвредность и отсутствие токсичности. Касаемо живых вирусных вакцин, которые производят для пероральной вакцинации диких животных, то необходимо доказывать их безопасность и эффективность на животных-мишенях и безопасность на животных, не являющихся целевыми видами (грызуны и другие дикие животные) [1, 2, 3].
По литературным данным существуют различные методы определения иммуногенной активности антирабических вакцин [4, 5, 6, 7]. Среди них можно отметить исследование сыворотки объемным методом Национальных Институтов Здравоохранения США (NIH), реакцию вируснейтрализации в культуре клеток (FAVN) и быструю реакцию подавления флуоресцирующего фокуса для определения нейтрализующих вирус бешенства антител (RFFIT) - (предписанные для международной торговли тесты); реакцию вируснейтрализации на мышах, иммуноферментный анализ (ИФА) с использованием моноклональных антител к протеину G и некоторые другие. Результаты выражаются в международных единицах или эквивалентных единицах относительно международной стандартной антисыворотки.
Кроме указанных методик на практике используют метод прямого заражения иммунизированных против бешенства плотоядных животных с использованием уличного (или стандартного контрольного) вируса бешенства против 5-50 или 10-100 МЛД50. Данная методика определения инфекционной активности связана с техническими сложностями: приобретение, содержание, иммунизация, заражение и содержание зараженных животных в течение всего периода наблюдения.
Большинство рассматриваемых методик определения иммуногенной активности при разработке были направлены на определение антител в сыворотках крови от парентерально иммунизированных животных (с использованием различных инактивированных антирабических вакцин). Применение этих методов создает ряд неудобств и ошибок при проведении исследований, а также связано с вышеописанными техническими сложностями.
Для контроля поствакцинального иммунитета у орально иммунизированных живыми вакцинами диких плотоядных животных ВОЗ и МЭБ рекомендуют реакцию вируснейтрализации в культуре клеток (реакция вируснейтрализации с флуоресцирующими антителами - FAVN) [5, 6]. Для постановки данной реакции необходимо получить опытную сыворотку крови в максимально стерильных условиях, так как она будет использована для работы с культурой клеток, а так же иметь стандартизированные питательные среды, реактивы, контрольные штаммы и референтные стандартные сыворотки.
Исходя из вышеизложенного, целью нашего исследования была попытка разработки возможной лабораторной модели определения иммуногенной активности (ИА) живой антирабической вакцины для диких плотоядных животных на лабораторных восприимчивых животных.
Материалы и методы исследования. Материалом для исследований служили опытные серии приманок с антирабической вирус-вакци-ной, содержащие аттенуированный фиксированный вирус бешенства Rabies virus fix, штамм «BGCM-V01». Биологический материал аттенуированного штамма вируса «BGCM-V01» положен в основу конструирования «Вакцины антирабической в блистер-приманках для пероральной иммунизации диких плотоядных животных».
Накопление вакцинного вируса проводили в перевиваемой культуре клеток BHK-21(cl-13) в роллерном монослое и глубинным суспензионным способом в лабораторном биореакторе Biostat-B.
Титр инфекционной активности полученного вируса проверяли методом титрования на мышатах при интроцеребральном заражении. Активность вируса составляла от 6,25 до 7,50 lg МЛД50/мл.
Для экспериментального контрольного заражения нами использовался фиксированный вирус бешенства штамм Challenge Virus Standard (CVS) в виде мозговой культуры, полученный в 1971 г. из лаборатории профилактики бешенства Института полиомиелита и вирусных энцефалитов АМН СССР. Вирус CVS был адаптирован к культуре клеток РЭК. Титр инфекционной активности вируса, использованного в экспериментах, составляет 7,0 lg МЛД50/мл.
Для исследования нами подобраны клинически здоровые нелинейные белые мыши из вивария ТОО «BiotronGroop» весом 12-15 грамм, при этом была поставлена задача определения иммунизирующей дозы для используемых мышей (и количества мышиных минимальных иммунизирующих доз содержащихся в одной оральной приманке для плотоядных животных).
Расчет вели от базового варианта иммунизации диких плотоядных животных: на среднестатистическую лисицу массой 5-6 кг для создания напряженного иммунитета должно быть введено орально 1-2 млн. МЛД50, и созданный иммунитет должен противостоять 10-100 МЛД50 контрольного вируса CVS.
В пересчете на живую массу лабораторных подопытных животных и, с учетом физиологических данных, они должны получить орально 5.620-56.200 МЛД50/гол. Иммунизировали мышей однократно орально в дозе вируса 5620-56200 МЛД в объеме 0,03 мл из шприца, не травмируя слизистую оболочку ротовой полости.
Через 21 день иммунизированных мышей подвергали экспериментальному контрольному заражению стандартом вируса CVS в дозе 10-100 МЛД50/0,03 мл. Параллельно стандартный вирус в дозе 10-100 МЛД50/0,03 мл вводили не иммунной группе контроля. Кроме того провели уточняющую титрацию заражающего материала, по итогам которой установили, что опытные и контрольные животные получили при заражении 31,6 МЛД50/0,03 мл.
Напряженность сформировавшегося иммунитета определяли по выживаемости мышей в течение 14 суток после экспериментального контрольного заражения.
За сутки до контрольного заражения (20-й день) у иммунизированных животных брали кровь для определения титров антител в реакции вирус нейтрализации на культуре клеток ВНК-21(с1-13) с постоянной дозой контрольного вируса CVS в дозе 10-100 МЛД50/0,03 мл (фактическая доза 31,6 МЛД50/0,03 мл). Реакцию нейтрализации ставили в 96-луночных планшетах, окрашивание проводили флуоресцеин изо-тиоцинатом антирабического конъюгата через 48 часов инкубации по стандартной методике. Конечный титр сывороточной нейтрализации определяется как фактор наивысшего разведения сыворотки, при котором 50% наблюдаемых микроскопических полей содержат одну или более инфицированных клеток. Результат РВН оценивали качественным образом: отсутствие флуоресцирующих клеток - минусовой учёт регистрируется в отношении лунки; наличие флуоресцирующих клеток (одна клетка или более) - плюсовой учёт регистрируется в отношении лунки.
Стандартная процедура постановки реакции вируснейтрализации с флуоресцирующими антителами на культуре клеток предписана ВОЗ и МЭБ для международной торговли [5, 6, 7].
Результаты исследований. Животных разделяли на 3 опытные группы и одну контрольную, с трехкратной повторностью каждого опыта.
Мыши первой опытной группы - по 6 голов (серия опыта №1) получали орально 562.000 МЛД50, второй группы - 56.200 МЛД50, третьей группы - 5.620 МЛД50.
Через 20 суток после экспериментальной иммунизации провели отбор крови у опытных и контрольных животных. Данные экспериментов оценки иммуногенной активности по уровню вируснейтрализую-щих антител в сыворотке крови вакцинированных животных в реакции вируснейтрализации представлены в таблице 1.
Таблица 1 Титры антител у иммунизированных орально опытных животных
| Серии экспериментов | Доза вируса для иммунизации и выживаемость мышей | Отрицательный контроль | ||
|---|---|---|---|---|
| 562.000 МЛД50 | 56.200 МЛД50 | 5.620 МЛД50 | ||
| Средний титр антител в группе | ||||
| Серия № 1 | 1:20 | 1:16 | 1:8 | 0 |
| Серия № 2 | 1:16 | 1:10 | 1:6 | 0 |
| Серия № 3 |
| 1:12 | 1:12 | 0 |
| Среднее значение в группе | 1:18 | 1:12,7 | 8,7 | 0 |
| Значение log2 | 4,17 | 3,67 | 3,12 | 0 |
Примечание: n=3, m=6
Результаты эксперимента свидетельствуют о формировании иммунного ответа при экспериментальной оральной иммунизации на уровне от 1:6 до 1:16 (3,0-4,0 log2) и выше. Так же прослеживается зависимость средних титров вируснейтрализующих антител и дозы вируса, полученной при иммунизации - от 1:8,7 до 1:18 при дозе 5.620 и 562.000 МЛД50, соответственно. По литературным данным полученные средние значения ВНА в экспериментальных группах обеспечивают защиту от заражения вирусом бешенства [1, 2, 3]. Эти данные были подтверждены на втором этапе исследовательской работы.
Через 21 день после иммунизации все три опытные группы и контрольная группа были заражены интрацеребрально контрольным стандартным вирусом CVS в дозе 31,6 МЛД50. Наблюдение за животными вели в течение 14 дней.
В первой серии опытов получены следующие результаты: в первой и второй группе все зараженные мыши выжили, в третьей группе -83,3 % животных выжили, при 100% падеже животных в контрольной не иммунизированной группе.
Во второй серии опытов группы мышей были иммунизированы и заражены по той же схеме. По итогам наблюдения - в первой и второй группе - 100% животных выжили, в третьей - 66,6%, в контрольной группе отмечалась - 100% гибель животных.
В третьей серии экспериментов с целью уточнения и расширения результатов исследования в опыт взяли 3 группы мышей, которых иммунизировали: первая группа - 56.200 МЛД50, вторая - 5.620 МЛД50, третья группа - 562 МЛД50, а через 20 дней провели контрольное заражение вирусом CVS. Через 14 дней наблюдения после заражения получены следующие результаты: в первой и второй группе - 100% животных выжили, в третьей все мыши пали, в контрольной группе пало - 66,6% мышей. По нашему мнению стопроцентная гибель мышей в третьей группе и выживаемость в группе контроля связаны с технической погрешностью при интрацеребральном заражении животных.
Итоговые данные проведенных экспериментов по иммунизации мышей и их выживаемости обобщены в таблице 2.
Таблица 2 Результаты выживаемости опытных животных после контрольного заражения
| Серии экспериментов | Доза вируса для иммунизации и выживаемость мышей, % | контроль,% | |||
|---|---|---|---|---|---|
| 562.000 | 56.200 | 5.620 | 562 | CVS | |
| Серия № 1 | 100 | 100 | 83,3 | - | 0 |
| Серия № 2 | 100 | 100 | 66,6 | - | 0 |
| Серия № 3 | - | 100 | 100 | 0 % | 33,4 |
| Среднее значение | 100% | 100% | 83,33% | - | - |
Примечание: n=3, m=6
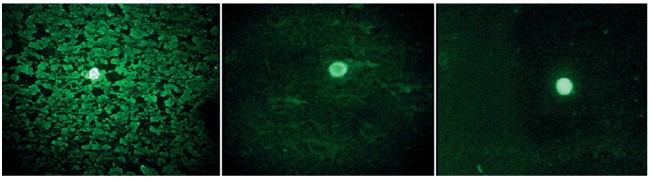
Из мозга павших животных подготовлены мазки-отпечатки и обработаны флуоресцирующим глобулином для обнаружения антигена вируса бешенства при люминесцентной микроскопии. Из 12 мазков-отпечатков в 10 было обнаружено характерное для антигена вируса бешенства свечение (тельца Негри), что подтверждает гибель мышей от лабораторного заражения контрольным штаммом вируса бешенства (рисунок 1).

Рис. 1. Характерное свечение вирусных частиц (тельца Негри) при обработке флуоресцирующим коньюгатом (РИФ), люминесцентная микроскопия
Таким образом, определена однократно вводимая иммунизирующая доза в 56.200 MLD для белых мышей массой 12-14 г, создающая защиту против 10-100 МЛД50/0,03 мл контрольного вируса CVS и являющаяся достаточной для образования защитного уровня вирусней-трализующих антител. Следует так же отметить, что иммунизирующая доза в 5.620 MLD защищает от 66,6 до 100% животных, что так же является удовлетворительным результатом.
Определенная нами оральная иммунизирующая доза для мышей (56200-5620 МЛД) коррелирует с дозой вируса для диких плотоядных животных (1-2 млн. МЛД), что свидетельствует об эффективности лабораторной модели определения иммуногенной активности оральной антирабической вакцины. Данные остальных групп иммунизации животных могут быть использованы в научных целях, потому что по современным требованиям определения безвредности при различных путях введения носят рекомендательный характер.
Заключение.
1. Определение иммуногенной активности антирабической вакцины на лабораторной модели позволило подобрать иммунизирующую мышиную дозу вакцины, которая защищает 100% животных при экспериментальном заражении контрольным вирусом бешенства CVS в дозе 10-100 МЛД50/0,03 мл. Однократно вводимая иммунизирующая доза для белых мышей массой 12-14 г составила 56.200 MLD50.
2. Полученные при экспериментальной иммунизации мышей титры ВНА от 1:8 до 1:16 (3,0-4,0 log2) и выше, свидетельствуют о напряженном иммунитете против бешенства.
Список литературы:
Резюме. Для каждого вида разрабатываемой вакцины, на животных-мишенях следует определить продолжительность и напряжённость иммунитета, выработанного в результате применения биопрепарата. Большинство применяемых методик определения иммуногенной активности связаны с техническими сложностями: приобретение, содержание, иммунизация, заражение и содержание зараженных животных в течение всего периода наблюдения, а так же создает ряд неудобств и ошибок при проведении исследований. Представлены результаты альтернативных исследований по изучению иммуногенной активности живой антирабической вакцины для пероральной иммунизации диких плотоядных животных. Рассматривается методика оценки иммуногенности с использованием модели оральной иммунизации на мышах при экспериментальном заражении контрольным вирусом бешенства CVS в дозе 10-100 МЛД50/0,03 мл. Однократно вводимая иммунизирующая доза для белых мышей массой 1214 г составила 56.200 MLD50, при этом титры ВНА составили от 1:6 до 1:16 (3,0-4,0 log2) и выше. Определенная нами оральная иммунизирующая доза для мышей (56200-5620 МЛД) коррелирует с дозой вируса для диких плотоядных животных (1-2 млн. МЛД), что свидетельствует об эффективности лабораторной модели определения иммуногенной активности оральной антирабической вакцины. Определение иммуногенной активности антирабической вакцины на лабораторной модели позволило подобрать иммунизирующую мышиную дозу вакцины, которая защищает 100% животных при экспериментальном заражении контрольным вирусом бешенства CVS. Полученные при экспериментальной иммунизации мышей титры ВНА от 1:8 до 1:16 (3,0-4,0 log2) и выше, свидетельствуют о напряженном иммунитете против бешенства.
Ключевые слова: бешенство, иммуногенная активность, напряженность иммунитета, антирабическая вакцина, поствакцинальный иммунитет, дикие плотоядные животные, пероральная иммунизация, оральная иммунизирующая доза.
Сведения об авторах:
Авилов Вячеслав Михайлович, доктор ветеринарных наук, член-корреспондент РАН; 119991, г. Москва, Ленинский проспект, 14; тел.: 8-901-9074326; e-mail: zolotovo-41@rambler.ru.
Бабак Виктор Александрович, кандидат ветеринарных наук, заведующий лабораторий биопрепаратов филиала РГП «Национальный центр биотехнологии» в г. Степногорске; 021500, Республика Казахстан, Акмолинская область, г. Степногорск, мкр. 4, д. 88/17; тел.: 8-71645-31478; e-mail: vgavm2003@mail.ru.
Пунтус Ирина Анатольевна, младший научный сотрудник, вирусолог РНИДУП «Институт экспериментальной ветеринарии имени С.Н. Вышелесского»; 220003, Беларусь, г. Минск, ул. Брикета, 28; тел.: +375-44-5454531; e-mail: bievm@tut. by.
Смаилова Айгерим Сериковна, младший научный сотрудник, вирусолог РНИДУП «Институт экспериментальной ветеринарии имени С.Н. Вышелесско-го»; 220003, Беларусь, г. Минск, ул. Брикета, 28; тел.: +375-44-5454531; e-mail: bievm@tut.by.
Ответственный за переписку с редакцией: Гусев Анатолий Алексеевич, доктор ветеринарных наук, профессор, член-корреспондент РАН, директор по науке АО «Покровский завод биопрепаратов»; 601125, Владимирская область, район Петушинский, пос. Вольгинский; тел.: 8-960-7365858; e-mail: anatgusev@tut.by.
http://vetkuban.com/num3_201902.html