УДК 619:615.373
Каплин В.С., Каплина О.Я. ФБУН "Государственный научный центр вирусологии и биотехнологии "Вектор" Роспотребнадзора, р.п. Кольцово
Введение. В конце XIX века, в лаборатории Коха Р. в Берлине, Беринг Э., Китазато С. и Вернике Е. разработали метод пассивной иммунизации животных и получили экспериментальное обоснование ценности данного подхода. А в 1892 г. Беринг Э. с сотрудниками приготовили первую лечебную специфическую противодифтерийную сыворотку, выделенную из крови барана, и применили её для лечения больных дифтерией детей. Позже, за эту работу в 1901 году Беринг Э. получил Нобелевскую премию по физиологии и медицине. Воодушевлённый работами Беринга Э. по пассивной иммунизации, Klemperer F. изучал иммунный ответ, вызванный столбнячным токсином на разных видах животных, в том числе и на курах. В 1893 году Klemperer F. [25] впервые описал феномен передачи антител против токсина столбняка из сыворотки иммунизированных кур в яичный желток. Эта работа не вызвала большого интереса у современников. До 1952 года нами было обнаружено лишь 10 работ, посвящённых использованию антител курицы и утки для пассивной иммунизации. Лишь с 1959 года, когда были опубликованы "Принципы гуманной экспериментальной техники" Russell W.M.S., Burch R.L. [51] интерес к открытию Klemperer F. стал очень медленно возрастать. Самый первый краткий обзор об использовании антител курицы появился ещё в 1919 г [55]. Современные аналитические обзоры литературы об использовании IgY стали публиковаться с 1992 года [53].
Изучение молекулярной структуры куриных антител проводились рядом исследователей, хотя они называли обнаруженные иммуноглобулины "IgG", также как основной класс иммуноглобулинов млекопитающих. Название "IgY" было предложено в 1969 году Leslie G.A. and Clem L.W., после того, как они смогли показать различия между иммуноглобулинами, обнаруженными в куриных яйцах и IgG млекопитающих [30]. Иммуноглобулин IgY является основным антителом, обнаруженным как в сыворотке крови, так и в яйцах кур (Gallusdomesticus), рептилий и земноводных [38]. Яичный желток - обильный источник иммуноглобулинов, общее количество которых превышает 100 мг на одно яйцо курицы. Кроме того, выделение IgY из яичного желтка - процедура относительно простая и не инвазивная. По сравнению с кроликом, из желтков одной курицы можно получить в 15-17 раз больше антител за тот же период. Это достоинство желточных IgY делает их незаменимыми при пассивной иммунизации человека и животных, что уже и делается в промышленных масштабах. Основной целью пассивного введения специфических антител является экстренное достижение быстрого лечебного эффекта и предупреждение дальнейшего развития болезни. Немедленное введение иммуноглобулина может спасти жизнь животного, представляя собой, таким образом, единственное эффективное средство для этой цели [1, 40]. В настоящее время сформировалось понятие "IgY-технологии" - получение и применение IgY-антител в аналитических и практических приложениях.
Иммунная система птиц. У птиц центральные органы иммунитета - эмбриональный желточный мешок, костный мозг, тимус и фаб-рициева сумка (бурса). Желточный мешок является первичным и главным кроветворным органом эмбриона. Он формируется в первые дни развития эмбриона, желточная масса которого служит энергетическим материалом.
Иммунная система защищает животных от вторгающихся из вне макро- и микроорганизмов, чужеродных молекул и злокачественных клеток. Иммунитет традиционно делят на врождённый и приобретённый (адаптивный). Врождённой иммунитет можно разделить на клеточный (фагоциты, гранулоциты) и гуморальный (лизоцим, интерфероны, система комплемента, медиаторы воспаления). Адаптивный (специфический) иммунитет зависит от способности распознавать чужеродные вещества, реагировать на них и запоминать информацию на случай повторного воздействия. Конкретные функции иммунной системы реализуются с помощью двух взаимодействующих механизмов, гуморального и клеточного иммунного ответа.
Млекопитающие защищают своё потомство в начале послеродового периода жизни путём пассивной иммунизации, используя молозиво богатое антителами. Антитела грудного молока нейтрализуют патогены в желудочно-кишечном тракте новорождённых. Организм птиц использует другую стратегию защиты. Во время формирования яиц, из крови в белок поступают иммуноглобулины IgA и IgM классов, а в желток - IgY [41]. Концентрация IgY в яичном желтке в 1,3-1,9 раза выше, чем в крови кур [50, 62]. При формировании органов и тканей цыплёнка антитела оказываются в кишечнике, частично разносятся по кроветворным органам. Кишечные антитела защищают вылупившегося цыплёнка от инфекций. Это тоже пассивная иммунизация, но антитела изначально находятся в просвете кишечника. Hamal K.R. с соавторами подтвердили, что 20-30% IgY от несушки передаются эмбриону [18].
Иммунная система птиц включает в себя первичные (эмбриональный желточный мешок, сумка Фабрициуса и тимус) и вторичные органы (селезёнка, гардерова железа, лимфатические узлы, костный мозг и лимфоидная сеть пищеварительного тракта). Фабрициева сумка это место дифференцировки стволовых клеток в В-клетки, в то время как тимус - место созревания стволовых клеток в Т-клетки [7, 54]. Селезенка является центром распространение плазматических клеток и клеток памяти [7].
Возможности иммунной системы млекопитающих довольно широки и создают условия по производству большого количества антител. Область ДНК, кодирующая вариабельную часть Н-цепей, содержит три группы генных сегментов, способных к рекомбинации: (V-variable) вариабельные, (D-diversity) сегменты разнообразия и (J-joining) соединительные, а также существуют процессы соматической рекомбинации и точечных мутаций [44, 47]. Они представлены большим числом вариантов. Для млекопитающих теоретически возможно образование более чем 1012 вариантов специфических иммуноглобулинов; однако биологически используемый и функционально важный перечень насчитывает, лишь примерно 104 специфичностей [2].
Птичьи антитела содержат как тяжелые (H), так и легкие (L) цепи, которые кодируются двумя несвязанными локусами. В лёгкой цепи есть только один сегмент, для каждого V и J региона. В то время как тяжёлая цепь имеется по одному сегменту для V и J региона и около 15 сегментов разнообразия (D) [54]. Поэтому перестройка мало способствовала бы увеличению B-клеток. Только D сегмент позволяет внести разнообразия в птичий геном [47, 48, 49]. Ещё одна особенность образования генов птиц состоит в том, что они состоят из псевдогенов. Ген иммуноглобулина у кур формируется путём копирования последовательности одного из 25 псевдогенов в единственный активный локус V-гена. Не останавливаясь на молекулярных механизмах формирования разнообразия антител птиц, следует отметить, что при участии всех псевдогенов, получается около 2.5*108 возможных комбинаций! Таким образом, несмотря на то, что у кур крайне ограничено число генов иммуноглобулинов, по сравнению с млекопитающими, они способны производить широкий спектр иммунных реакций и разнообразных антител, не отличающихся, а, иногда, превосходящих по уникальности антитела млекопитающих [54, 63].
Иммуноглобулины птиц. У птиц обнаружено три класса иммуноглобулинов: IgA, IgM, и IgY [1]. IgA и IgM похожи на иммуноглобулины млекопитающих. Куриные IgY является функциональным эквивалентом IgG, основным сывороточным антителом, обнаруженным у млекопитающих [8]. В сыворотке кур концентрация IgY, IgA и IgM составляет 5.0, 1.25, и 0.61 мг/мл, соответственно [31]. У млекопитающих, передача материнских антител может произойти после рождения через молозиво и молоко, однако у птиц, материнские антитела должны быть переданы в развивающийся эмбрион, чтобы дать иммунную защиту цыплёнку [7, 61]. Антитела IgA и IgM секретируются в созревающем фолликуле яйца и выводятся вместе с белком. Сывороточный IgY селективно передается через желточные рецепторы на поверхности мембраны желтка, который специфичен для IgY транслокации [34, 41, 64]. Morrison S. L. с соавторами определили несколько областей в пределах молекулы антитела важных для его поглощения в яичный желток. Эти данные говорят о том, что шарнирная область антител, но несвязанная с Fc углеводным фрагментом необходима для этой транслокации .
Яичный белок содержит IgA и IgM в концентрациях около 0.15 и 0.7 мг/мл, соответственно, а желток - IgY от 5 до 25 мг/мл [32, 50, 52]. У кур не было выявлено эквивалентов IgE и IgD млекопитающих [54].
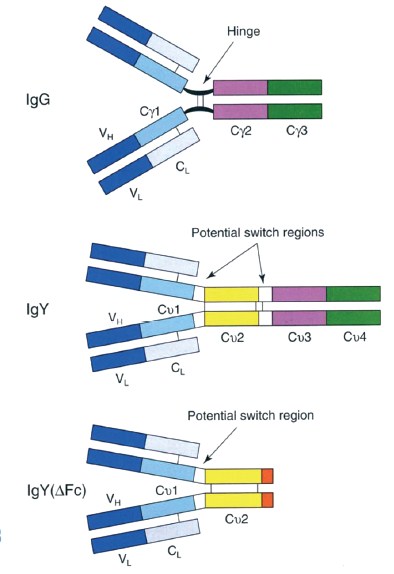
Структура IgY. Хотя куриный IgY аналогичен по функциям IgG млекопитающих, структурно они отличаются [7]. IgY птиц является системным, а не секреторным антителом (как, например IgA). Валентность IgY - два, так же как и у млекопитающих [66], хотя есть данные, что кажущаяся валентность куриных желточных иммуноглобулинов может быть более двух, так как антигенсвязывающий участок IgY больше чем у млекопитающих [21, 65]. По структуре ДНК последовательность IgY кур больше напоминает последовательность IgE человека. IgY имеет молекулярную массу ~180 ^а (коэффициент седиментации 7.8 S), что легче IgG ~150 ^а (коэффициент седиментации 7,0 S) млекопитающих. Общая структура молекулы IgY состоит из двух идентичных тяжелых (H) цепей и двух идентичных легких (L) цепей, которые связаны дисуль-фидными мостиками. Молекулярная масса тяжёлой цепи IgY составляет ~68 ^а, а лёгкой цепи ~ 25 ^а. Молекулярная масса тяжёлой цепи IgG составляет ~50 ^а, а лёгкой цепь 18-20 kDa. Цепь H IgG состоит из четырёх областей: вариабельный домен (VH) и три константных домена (Су1, Су2 и Су3). Домен Су1 отделён от Су2 домена шарнирной областью, что даёт значительную гибкость Fab фрагментам. C другой стороны, H цепь IgY не имеет чётко выраженной шарнирной области, но есть область, вблизи границы 0v1-0v2 и 0v2-0v3 доменов, содержащих про-линовые и глициновые остатки. Эти регионы придают ограниченную гибкость молекуле IgY [7].
Молекула IgY состоит из четырёх константных доменов (С/1-С/4) в дополнение к переменной области (VH). Сравнение IgG и IgY показало, что связь доменов Су2 и СуЭ IgG слишком похожи на и Gv4 IgY, соответственно (рисунок 1). Эквивалентная IgY Сv2 область в IgG отсутствует, а на её месте расположен шарнирный участок [66]. Fc фрагмент иммуноглобулинов является местом приложения большинства биологических эффекторных функций. Н цепь IgY содержит две углеводные боковые цепи, в отличие от одной у IgG (на рисунке не показано). Эти углеводные фрагменты расположены на Сv2 и Сv3 доменах тяжёлой цепи, в отличие от IgG который связан с Су2 доменом. Кроме того, структура сахаридов в IgY отличаются от любого иммуноглобулина млекопитающих и содержит олигосахариды типа GlclMan7-9GlcNAc2 Г37. 421.

Рис. 1. Структура иммуноглобулинов млекопитающих, кур и уток
В состав лёгких цепей иммуноглобулинов IgY кур и уток входят
только Л цепи [6].
Иммунный ответ уток несколько отличается от иммунного ответа кур. Это связано с особенностями структуры IgY уток. Сывороточный и желточный иммуноглобулины уток представлены двумя изоформами: полной (IgY) изоформой, и (IgYAFc) у сечённой, в то время как у кур, существует только полная изоформа. Обе изоформы иммуноглобулинов уток являются продуктом одного гена. Тяжёлая цепь IgY(AFc) усечена на два домена с С-конца - Сv3 и Сv4 [36] и имеет молекулярную массу 120 ^a (коэффициент седиментации 5.7 S) следовательно, и функции IgY(AFc) усечены тоже. IgY(AFc) не способен к опсонизации и фиксации комплимента [15, 66] и, предположительно, играет роль в нейтрализации свободных антигенов. Соотношение IgY и IgY(AFc) в сыворотке одной утки не постоянно и составляет 15-25% : 85-75%, что было показано при гипериммунизации бычьим сывороточным альбумином [66]. По данным Чиоу Й-Нэн в яичном желтке сохраняются те же тенденции, что и в сыворотке. Общее количество желточных иммуноглобулинов, содержащихся в одном утином яйце, оценивается в 15-80 мг IgY и 45-240 мг IgY(AFc) [3].
Физико-химические и биологические свойства IgY. Изоэлектри-ческая точка (pI) молекул IgY находится в промежутке pH 5.7 - 7.6, а pI молекул IgG млекопитающих составляет рН 6.1 - 8.5. Коэффициент молярной экстинкции (s) IgG кролика - 1.43; IgY курицы - 1.33-1.36; IgY(AFc) утки - 1.38 [12, 45, 46, 61].
Как уже отмечалось, температура тела птиц составляет 41°C, поэтому и период полураспада IgY в крови птицы составляет 36-48 часов. Извлечённые из желтка, они сохраняют свою активность в течение 6 месяцев при комнатной температуре или в течение одного месяца при температуре 37°C. Активность IgY сохраняется при 70°C в течение 15 минут [56, 57], и полностью денатурирует при температуре выше 75°C [10].
Замораживание и сублимационная сушка - процессы, которые не вызывают сильных изменений молекул. Тем не менее, белки, могут потерять специфическую активность в результате агрегации, адсорбции информационных изменений [59]. Замораживание и сублимационная сушка не влияет на активность IgY, если даже повторяется несколько раз [56]. По данным Chansarkar N.L. лиофильная сушка препаратов IgY привела к некоторой потере антиген-связывающей активности и значительному снижению растворимости в условиях высокой концентрации солей [11]. Изучение термической стабильности IgY проводилось в диапазоне температур от 25°C до 90°C в течение 15 минут после замораживающей сушки. Результаты показали, что лиофилизированные IgY были стабильны и сохранили иммунологическую активность [14].
Был проведён анализ свойств IgY, полученных распылительной и сублимационной сушилками водорастворимой доли яичных желтков полученных от кур, иммунизированных Escherichia coli [67]. По сравнению с лиофилизированным, порошок, полученный методом распыления не дал значительных изменений в титрах антител, даже когда несколько сушек проводили распылением с температурой от 140°С до 170°С. Тем не менее, повышенная влажность порошка наблюдалось в распылительной сушилке, а не сублимационной.
Стабильность IgY к кислоте и щелочи изучались в различных условиях. Было установлено, что активность IgY была снижена при рН 3.5 и ниже, и необратимо терялась при рН 3 [56, 57, 58]. Быстрое снижение активности IgY при низких значениях рН указывает на конфор-мационные изменения и повреждения в Fab фрагменте, в том числе, антиген-связывающем участке. В щелочной среде активность IgY не меняется, пока рН не увеличится до 11. Тем не менее, она заметного уменьшилась при рН 12 и выше [56, 57, 58]. Аналогичные результаты были представлены и другими авторами [19, 29, 35].
IgY относительно устойчив к трипсину или химотрипсину, но довольно чувствителен к пепсину. Почти вся активность IgY была потеряна после переваривания пепсином, но 39% и 41% активности сохранилось после 8 ч инкубации с трипсином или химотрипсином, соответственно [19]. Стабильность IgY против пепсина сильно зависит от рН и фермент-субстратного соотношения. При рН 5 или выше, молекулы IgY довольно устойчивы к пепсину и сохраняли свою анти-ген-связывающий и клеточно-агглютинационную активность. Тем не
менее, при рН 4.5 и ниже, эта активность исчезает [56]. Переваривание IgY пепсином при рН 2 даёт в результате полный гидролиз молекул антител и короткие пептиды. После триптического переваривания, IgY сохраняет свою антиген-связывающию и клеточно-агглютинационную активность.
Стафилококковый белок А, стрептококковых белок G и пеп-тострептококковый белок L - бактериальные белки, которые широко используются для аффинного выделения IgG млекопитающих. Стафилококки и стрептококки могут встречаться в образцах сывороток. Они могут связываться с антителами и вызывать ошибочные результаты в иммунологических анализах. Куриные антитела не реагируют ни с белком А, ни с белком G и белком L и могут быть использованы для снятия проблем интерференции Fc рецепторов [5, 13, 16]. Однако IgY утки способны связываться с белком А и слабо с белком G, в условиях колоночной хроматографии [20]. IgY, полученные из желтков яиц страуса, показывают от слабой до умеренной активности по отношению к белку А золотистого стафилококка в условиях аффинной хроматографии, и не взаимодействует с белком G стрептококка [23]. Justiz Vaillant A. A. с соавторами установили, что белок L пептострептококка слабо взаимодействует с желточными иммуноглобулинами кур и страусов. Эти же авторы описали слабое связывание белка А золотистого стафилококка с куриными, утиными и страусиными IgY-иммуноглобулинами [24].
Преимущества IgY по сравнению с IgG. Одно из основных требований по содержанию лабораторных животных является их здоровье и снижение количества болезненных манипуляций. При использовании IgY-технологий эти требования выполняются, так как сбор антител от курицы сводится к не инвазивному сбору яиц. Хранить яйца можно при 4°С в течение 6 месяцев и более без потери активности антител. IgY-технология также обеспечивает превосходные экономические преимущества, так как затраты на содержание кур ниже, чем затраты на содержание кроликов. Кроме того, количество IgY, полученных от одной курицы соответствует, примерно, количеству IgG полученному от овцы или козы. Из сыворотки одного подопытного кролика за год можно получить 2,4 г. IgG, причём лишь 1-5% из них будут проявлять специфическую активность. А одна курица способна произвести примерно 17-35 г IgY в год, из которых 1-10% являются антиген-специфичными [32, 50, 52]. Большое количество желточных антител открывает возможности для новых областей применения IgY, таких как иммунотерапия и иммунопрофилактика.
В зарубежной литературе есть сведения о цене препаратов IgY. Стоимость 1 г куриных антител составляет примерно $ 10, в то время как 1 г IgG млекопитающих стоит $ 20000 [33].
Существует большая филогенетическая дистанция между млекопитающими и птицами, но она значительно меньше, чем разница между двумя видами млекопитающих. Это означает, что перекрёстных реакций между IgG и IgY практически нет [17]. Было показано, что курица производит в 3-5 раз больше антител к иммуноглобулинам кролика, чем свинья [22, 43]. А эпитопы куриных антител не совпадают с эпитопами антитела млекопитающих. Репертуар птичьих антител значительно шире репертуара антител млекопитающих [60].
Часть анализов в ветеринарных лабораториях проводятся на образцах сывороток животных. Вновь полученные (свежее) сыворотки содержит активные компоненты системы комплемента и могут оказать отрицательное влияние на проведение имунноферментного анализа, активируя систему комплемента [27]. Активированный С4 компонент связывается с Fс фрагментом IgG и может связываться с антигеном [9]. Компоненты комплемента могут также растворять осаждённые иммунные комплексы и предотвращать от осаждения растворимые иммунные комплексы [4, 39]. У птиц также обнаружена система комплемента, но в ней, по мнению некоторых авторов, отсутствуют компоненты С2 и С4, то есть те, с которыми связывают неспецифические иммунологические реакции [10]. Затруднения впроведении иммунологических реакций, вызванные активацией комплемента млекопитающих можно значительно снизить, используя антитела кур [28].
К недостаткам IgY-технологий можно отнести сложности с образованием иммунных преципитатов, когда антиген смешивают с антителом. Эта техника используется в нефелометрии. Только часть куриных антител осаждается на физиологических концентрациях солей, а около 25% антител остаются в супернатанте при максимальном осадке. Динамика образования осадка напоминает кривую, полученную с лошадиными антителами, то есть в избытке антигена осадок быстро растворяется. Для увеличения силы преципитации необходимо повысить молярность раствора NaCl с 0.15 М до 1.5 М [26, 45, 56].
Желточные антитела птиц - относительно новый класс антител, обладающих рядом преимуществ. Их низкая цена и отсутствие токсичности дают возможность получать иммунологические препараты в промышленных масштабах. IgY-технологии - это перспективное направление не только в лечении сельскохозяйственных животных, существенно снижающих роль антибиотиков, но и дающих возможность получения диагностических средств с высокой специфичностью. IgY-технологии широко используются в ветеринарии Германии, Канады, Японии, Китая, Южной Кореи и других государствах.
Список литературы:
Резюме. Несмотря на то, что специфические антитела были обнаружены в куриных желтках в 1893 г., лишь с 1969 г. начались серьёзные исследования по изучению и практическому применению этих антител в научных исследованиях и терапии. Птичьи яйца представляют идеальный альтернативный источник антител к большинству антигенов, так как куриные низкомолекулярные иммуноглобулины (IgY) из крови курицы транспортируется в яйцеклетку и накапливается в яичном желтке в больших количествах. Сущность IgY-технологии была хорошо документирована в последних исследованиях, много работ посвящено описанию и характеристике, производства и очистке IgY. Желтки яиц, снесённых иммунизированными курами, были признаны отличным источником поликлональных антител уже более сорока пяти лет. Этот простой неинвазивный подход представляет привлекательную альтернативу традиционным методам производства поликлональных антител. Использование иммуноглобулиновой терапии расширяет арсенал доступных для борьбы с патогенами методов в медицине и ветеринарии, IgY является перспективным кандидатом, как в качестве альтернативы антибиотикам, так и в качестве полезного инструмента в области исследований и диагностики.
Ключевые слова: иммуноглобулины; IgY; IgY-технологии; пассивная иммунизация; желточные антитела; желточный мешок; адаптивный иммунитет; сумка Фабрициуса; тимус; селезёнка.
Сведения об авторах:
Каплина Ольга Николаевка, старший научный сотрудник ФБУН Государственный научный центр вирусологии и биотехнологии "Вектор" Роспотребнадзора; 630559, Новосибирская область, р.п. Кольцово; e-mail: forelat@ngs.ru.
Ответственный за переписку с редакцией: Каплин Владимир Сергеевич, кандидат биологических наук, старший научный сотрудник ФБУН Государственный научный центр вирусологии и биотехнологии "Вектор" Роспотребнадзора; 630559, Новосибирская область, р.п. Кольцово; email: kaplin_@ngs.ru.
http://vetkuban.com/num3_201802.html