Кощаев А. Г., Кобыляцкая Г. В., Мигина Е. И., Кощаева О. В.
ФГБОУ ВПО "Кубанский государственный аграрный университет",
г. Краснодар
Перепеловодство в настоящее время является одним из перспективных направлений птицеводства как наиболее ин-V тенсивно развивающаяся и экономически выгодная отрасль сельского хозяйства. Однако, выращивание перепелов по промышленным технологиям существенно отличается от жизни в природных условиях. Это вызывает у птицы трудности адаптации к искусственным условиям и приводит к нарушению гомеостаза, снижению иммунитета и, как следствие, ухудшению качественных показателей выхода продукции - мяса и яиц [7, 20, 22].
Среди причин отхода молодняка сельскохозяйственной птицы основное место занимают болезни желудочно-кишечного тракта, возбудителями которых является условно-патогенная микрофлора. Микроэкологические изменения бактериального баланса в пищеварительном тракте птенцов приводят к возникновению патологических состояний, что нарушает переваривание и усвоение питательных веществ [20, 24].
Кроме того, применение антибиотиков и других антимикробных средств оказывает негативное влияние на микробные экологические системы пищеварительного тракта птицы, вызывая возникновение дисбактериоза. Это приводит к нарушению обмена веществ, снижению резистентности и продуктивности птицы, распространению желудочно-кишечных заболеваний [1, 7, 8].
Для повышения резистентности и сохранности птицы применяют различные препараты растительного и животного происхождения: антибактериальные препараты, пробиотики, пребиотики, витаминно-минеральные добавки, органические кислоты, иммуномодуляторы и другие [9, 10, 14, 15, 16, 17].
В настоящее время в птицеводстве наблюдается снижение интенсивности применения кормовых антибиотиков в качестве добавок, что обусловлено решением Европейского союза. В связи с этим, широкое применение в птицеводстве нашли пробиотики, как наиболее доступные на рынке и безвредные для организма птицы препараты [11, 12, 13].
Исходя из того, что пробиотики по своей природе должны оказывать существенное влияние на формирование микробиоценоза пищеварительного тракта перепелов, состав микрофлоры, физиологические и продуктивные показатели птицы, целью нашей работы стало изучение микробиоценоза кишечника перепелов при промышленном содержании. Кроме того, мы изучали возможность коррекции состава кишечной микрофлоры моно- и полиштаммовыми пробиотиками на основе молочнокислых бактерий.
Материалы и методы исследования. Исследования выполнялась на кафедре биотехнологии, биохимии и биофизики Кубанского госагроуниверситета в период 2010-2012 гг. В работе использовался пробиотический препарат Пролам (ООО "Биотехагро"). Он представляет собой суспензию, содержащую пятиштаммовую микробную композицию молочнокислых бактерий, относящихся к трем родам этой физиологической группы. Пролам служил положительным контролем и применялся в кормлении перепелов первой опытной группы.
Остальные опытные группы, за исключением последней, потребляли моноштаммовые формы экспериментальных препаратов, содержащих Lactobacillus acidophilus В-3235, L. delbrueckii ssp. bulgaricus В-5788, Lactococcus lactis ssp. lactis В-3145, Bifidobacterium animalis АС-1248. В 6-й опытной группе применялся экспериментальный пробио-тик, содержащий три штамма молочнокислых бактерий, относящихся к различным родам: Lactobacillus acidophilus В-3235, L. delbrueckii ssp. bulgaricus В-5788 и Lactococcus lactis ssp. lactis В-3145. Перепелов всех групп кормили полнорационным комбикормом, а препарат применялся согласно рекомендациям производителя пробиотика Пролам.
Результаты и обсуждение. Как установлено нами ранее, использование в составе корма перепелов пробиотических добавок приводит к увеличению сохранности и продуктивности, что, в первую очередь, связано с активизацией метаболических процессов и повышением неспецифической резистентности [4, 5, 6].
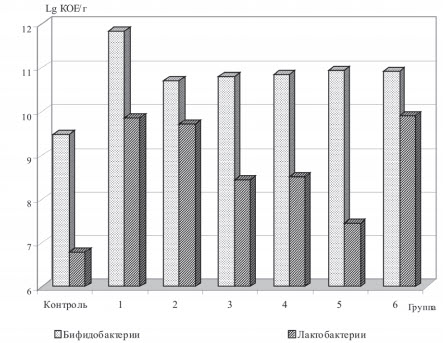
Основные представители нормальной микрофлоры кишечника птиц - бифидо- и молочнокислые бактерии. Их сообщества расположены на поверхности слизистой оболочки, примыкая к мембранам энтероцитов, или локализованы в непосредственной близости от поверхности эпителия в слое муцина, покрывающего мембраны эпителиальных клеток [21, 23]. С целью определения влияния пробиотических моно- и полиштаммовых кормовых добавок на количество лакто- и би-фидобактерий в составе микробиоценоза желудочно-кишечного тракта перепелов, было проведено микробиологическое исследование химуса кишечника (рисунок 1).

Рис. 1. Количество лакто- и бифидобактерий в химусе кишечника перепелов на 42-е сутки выращивания, lg КОЕ/г
Как видно из представленных данных, во всех группах содержание лакто- и бифидобактерий изменяется в зависимости от состава пробиотика. Используемые в опыте пробиотические добавки оказывают существенное влияние на содержание основных симбионтных групп микроорганизмов, в первую очередь лактобактерий.
Обладая антагонистической активностью в отношении гнилостной, патогенной и условно патогенной микрофлоры, лактобактерии подавляют рост микроорганизмов группы кишечной палочки, сальмонелл, стафилококков и других. Это свойство обусловлено способностью лактобактерий синтезировать многочисленные антибиотические вещества (лактацины, лактабиотики, ряд неизвестных пока соединений с антибактериальным действием), перекись водорода, лизоцим, интерферон, интерлейкин, а также их адгезивными и иммуномодулирующими свойствами [2, 20].
Так, применение полиштаммовых пробиотиков и Lactobacillus acidophilus при выращивании перепелов позволило значительно повысить титр лактобактерий: в 1-й опытной группе на 45,6%, во 2-й - на 43,4%, в 6-й - на 46,2%. В остальных опытных группах колебания были менее значимы - от 24,6% в 3-й, потреблявшей Lactobacillus delbrueckii ssp. bulgaricus, до 9,9% в 5-й, которой скармливали Bifidobacterium animalis. В целом, применение пробиотиков повышало титр лактобак-терий в химусе, так как в состав добавок входили штаммы, которые относятся к этому роду. В последнем случае (5-я опытная группа) низкие результаты легко объяснимы отсутствием в пробиотике, потребляемом этой группой перепелов, представителей рода Bifidobacterium.
Несколько иная картина получена при анализе химуса на содержание представителей рода Bifidobacterium. Общеизвестно, что наличие группы микроорганизмов в кишечнике препятствует размножению патогенных и условно-патогенных бактерий и в целом нормализует микробиоценоз кишечника. Антагонистическая активность бифидобак-терий обеспечивается за счет образования субстанций с антибиотической активностью и летучих жирных кислот, конкурентоспособной адгезии на энтероцитах; иммуномодулирующей активности и пищевой конкуренции [18, 19].
Установлено, что наши пробиотики увеличивали титр бактерий этой группы, однако не так значительно, как в случае с лактобактериями. Так, максимальное количество изучамых бактерий зафиксировано 10 в 1-й опытной группе (7,3*10 КОЕ/г), что выше контроля на 25,1%. Применение моноштаммовых пробиотиков увеличивало содержание бифидобактерий не так активно. При этом, данная тенденция отмечена во 2-й опытной группе (возрастание на 12,9%), в 3-й опытной группе (на 14,0%), в 4-й опытной группе (на 14,7%), в 5-й опытной группе (на 15,6%). Экспериментальный трехштаммовый пробиотик, содержащий Lactobacillus acidophilus, L. delbrueckii ssp. bulgaricus и Lactococcus lactis ssp., обеспечил увеличение изучаемого показателя относительно контроля на уровне использования бифидобактериального препарата, состав 8,1*1010 КОЕ/г, против контроля - 0,3*1010 КОЕ/г. Закономерность увеличения количества бифидобактерий без их внесения в составе пробиотика объяснима созданием благоприятной среды для их развития в кишечнике за счет лактобактерий, входящих в состав препаратов.
В целом, можно отметить, что использование пробиотиков позволяет увеличить содержание в химусе кишечника перепелов как лакто-, так и бифидобактерий, а также повышает долю лактобактерий в общем количестве симбионтных микроорганизмов химуса.
Общеизвестно, что механизм действия пробиотиков направлен не на уничтожение части популяции кишечных микроорганизмов, а на заселение кишечника микроорганизмами-пробионтами, которые регулируют численность условно патогенной микрофлоры путем вытеснения ее из состава кишечного микробиоценоза [3, 7].
При диареях, в том числе при энтеритной форме эшерихиоза, констатируют дисбактериоз, который проявляется изменением количественного и качественного состава микрофлоры, нарушением соотношения между ее представителями в ЖКТ, в первую очередь, в толстом и тонком кишечнике. Сами же изменения количественного и качественного состава нормальной и условно патогенной кишечной микрофлоры приводят к нарушению процессов пищеварения и развитию диарей. Поэтому, в систему промышленного выращивания перепелов необходимо включить профилактические средства формирования нормобиоза и колонизационной резистентности, важнейшим из которых являются препараты на основе молочнокислых бактерий.
Поэтому, для определения влияния наших пробиотических моно- и полиштаммовых кормовых добавок на качественный и количественный состав микробиоценоза желудочно-кишечного тракта перепелов было проведено микробиологическое исследование основных групп бактерий химуса кишечника (рисунок 2).
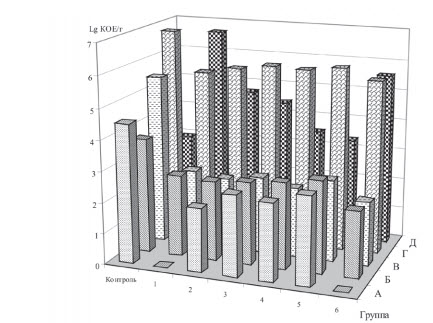
Рис. 2. Количество клостридий (А), стрептококков (Б), стафилококков (В), кишечной палочки (Г),
энтерококков (Д) в химусе кишечника перепелов на 42-е сутки выращивания, lg КОЕ/г
Как видно из представленных данных, используемые про-биотики повышают содержание энтерококков в химусе перепелов 1-й опытной группы в 2,3 раза, 2-й опытной - в 1,6 раза, 3-й опытной - 1,5 раза, 4-й опытной - 1,2 раза, 5-й опытной - 1,1 раза, 6-й опытной - 1,9 раза. При этом максимальным стимулирующим воздействием на развитие этой группы бактерий отличаются полиштаммовые пробиотики, которые обеспечивают титр бактерий на уровне 4,8*106 КОЕ/г (1-я опытная группа) и 3,8*105 КОЕ/г (6-я опытная группа) соответственно, против - 0,9*103 КОЕ/г химуса в контроле.
На Escherichia coli, напротив, изучаемые пробиотики действовали угнетающе. Так, они снижали титр кишечной палочки на 33,7% в 1-й опытной группе, на 30,6% - во 2-й, на 28,1% -в 3-й, на 28,9% - в 4-й, на 26,9% - в 5-й и на 31,7% - в 6-й опытной группе. Таким образом, вне зависимости от бактериального состава пробиотика ингибирование, в сравнении с контролем, составило от 26,9 до 33,7%.
Анализ количества бактерий паратифозной группы показал, что полиштаммовые пробиотики (1-я и 6-я опытные группы) и Lactobacillus acidophilus (2-я опытная группа) более существенно снижают ее количество в химусе кишечника перепелов. Так, достоверно (P < 0,05) снижается этот показатель на 38,5% (1-я опытная), на 21,7% (2-я опытная), на 35,2% (6-я опытная). В остальных группах колебания были недостоверны (P < 0,05) и менее значимы - от 10,2% (5-я опытная группа, потреблявшая Bifidobacterium animalis), до 19,8% (3-я опытная группа, которой добавляли в корм Lactobacillus delbrueckii ssp. bulgaricus).
Содержание стафилококков в контрольной группе находилось на достаточно высоком уровне (3,2*105 КОЕ/г). Применение пробиоти-ков обеспечило существенное снижение титра этой группы микроорганизмов: в 1-й опытной группе в 2,2 раза, во 2-й - в 2,3 раза, в 3-й - 2,2 раза, в 4-й и 5-й опытных группах - 2,1 раза. Причем, как и в случае с кишечной палочкой, в большинстве опытных групп состав препарата не оказывал существенного влияния на степень ингибирования патогена. Следует отметить, что максимальное ингибирующее воздействие на развитие стафилококков оказал экспериментальный полиштаммовый пробиотик (6-я опытная группа), который обеспечивал снижение титра бактерий до 1,2*102 КОЕ/г в сравнении с контролем - 3,2*105 КОЕ/г химуса.
При использовании пробиотиков в составе корма для перепелов происходило изменение титра стрептококков. Значительное снижение, по сравнению с контролем, зафиксировано только в группе, потреблявшей экспериментальный трехштаммовый пробиотик, содержащий Lactobacillus acidophilus, L. delbrueckii ssp. bulgaricus и Lactococcus lactis ssp. (6-я опытная), где титр снизился в 1,7 раза. В остальных группах (1-я, 2-я и 3-я опытные группы) различия менее значимы: титр снизился в 1,4 раза. В остальных группах ингибирование пробиотиком стрептококков химуса было минимально - в 4-й и 5-й опытных группах, потреблявших Lactococcus lactis ssp. lactis и Bifidobacterium animalis, титр составил 6,3*102 КОЕ/г и 9,8*102 КОЕ/г, соответственно, что ниже контроля только в 1,3 и 1,2 раза.
Применение полиштаммовых пробиотиков обеспечило отсутствие клостридий в химусе перепелов. В группах перепелов, потреблявших моноштаммовые пробиотики, происходило снижение титра этих бактерий в 2,2 раза (2-я опытная), 1,7 раза (3-я опытная), 1,8 раза (4-я опытная) и 1,6 раза (5-я опытная) в сравнении с контролем, где титр составил 3,2*104 КОЕ/г.
Результаты исследований согласуются с исследованиями Е.В.Якубенко с соавторами (2006, 2009), которые при скармливании использовали пробиотик Бацелл и Моноспорин на птице отмечали увеличение количества полезных микроорганизмов (лакто- и бифидобактерий) и снижение содержания потенциальных патогенов в кишечнике. При этом, у перепелов повысились иммунологические показатели и продуктивность [24, 25]. Нами, в более ранних опытах показано, что использование в яичном и бройлерном птицеводстве этих пробиотиков позволило, за счет развития бифидо- и лактобактерий, вытеснить условно патогенную микрофлору (эшерихий, энтерококков и стафилококков), что привело к повышению жизнеспособности, улучшению переваримости компонентов корма и в итоге - к возрастанию прироста живой массы [2].
Таким образом, на основе проведенных нами микробиологи-чесих исследований, подтвержденных другими авторами, установлено, что под влиянием наших пробиотических кормовых добавок более активно происходило размножение лакто- и бифидобактерий, они оказывали ингибирующее действие на размножение в желудочно-кишечном тракте перепелов условно патогенных микроорганизмов. Причем лучшие результаты по содержанию лакто- и бифидобактерий показали по-лиштаммовые пробиотики, которые обеспечили значительное снижение количества условно патогенных бактерий в химусе кишечника перепелов.
Список литературы:
Реферат.
На основе результатов исследований получены данные об основных представителях микробиоценоза кишечника клинически здоровых перепелов породы фараон. Использование экспериментальных пробиотиков на основе молочнокислых бактерий стимулировало размножение лакто- и бифидобактерий, которые оказывали ингибирующее действие на размножение в желудочно-кишечном тракте перепелов условно-патогенных микроорганизмов.
Ключевые слова: пробиотик, кормовая добавка, молочнокислые бактерии, птицеводство, перепела, микробиоценоз кишечника, желудочно-кишечный тракт.
Сведения об авторах:
Кобыляцкая Галина Владимировна, аспирант ФГБОУ ВПО "Кубанский государственный аграрный университет"; 350044, г. Краснодар, ул. Калинина, 13; тел.: 8 (861) 221-57-84 e-mail: galina.k.doctor@gmail.com.
Мигина Елена Ивановна, аспирант ФГБОУ ВПО "Кубанский государственный аграрный университет"; 350044, г. Краснодар, ул. Калинина, 13; тел.: 8 (861) 221-57-84; e-mail: emd@kubsau.ru.
Кощаева Ольга Викторовна, кандидат сельскохозяйственных наук, доцент кафедры безопасности жизнедеятельности и БЖД ФГБОУ ВПО "Кубанский государственный аграрный университет"; 350044, г. Краснодар, ул. Калинина, 13; тел.: 8 (861) 221-57-84; e-mail: kagbio@mail.ru
Ответственный за переписку с редакцией: Кощаев Андрей Георгиевич, доктор биологических наук, профессор кафедры биотехнологии, биохимии и биофизики ФГБОУ ВПО "Кубанский государственный аграрный университет"; 350044, г. Краснодар, ул. Калинина, 13; тел.: 8 (861) 221-57-84; e-mail: kagbio@mail.ru .
UDC 636.5.083.3+636:612.015.3
DIGESTIVE TRACT MICROBIOCENOSIS OF QUAIL AND ITS PROBIOTIC CORRECTION
Koshchaev A. G., Kobylyatskaya G. V., Migina E. I., Koshchaeva O. V..
Summary. Alimentary diseases caused by pathogenic microflora, are the most common cause of young poultry loss. Authors studied quail gut microbiota in industrial conditions. Data on the main representatives of the gut microbiota of healthy quail breed Pharaoh were obtained on the basis research results. Use of experimental probiotics based on lactic acid bacteria stimulated proliferation of bifidobacteria and lactobacilli, which have an inhibitory effect on the reproduction of opportunistic pathogens in the digestive tract of quail.
Key words: probiotics, gut microflora, lactic acid bacteria, poultry, quail, gut microflora, digestive tract.
References:
Author affiliation:
Kobylyatskaya Galina V., postgraduate student of the Kuban State Agrarian University; 13, Kalinina st., Krasnodar, 350044: phone: 8 (861) 221-5784; e-mail: galina.k.doctor@gmail.com.
Migina Elena I., postgraduate student of the Kuban State Agrarian University; 13, Kalinina st., Krasnodar, 350044; phone: 8 (861) 221-57-84; e-mail: emd@kubsau.ru.
Koshchaeva Olga V., Ph.D. in Agriculture, docent of the Kuban State Agrarian University; 13, Kalinina st., Krasnodar, 350044; phone: 8(861)221-57-84; e-mail: kagbio@mail.ru.
Responsible for correspondence with the editorial board: Koshchaev Andrey G., D.Sc. in Biology, professor of the Department of biotechnology, biochemistry and biophysics of the Kuban State Agrarian University; 13, Kalinina st., Krasnodar; 350044; phone: 8(861)221-57-84; e-mail: kagbio@mail.ru.
http://vetkuban.com/num3_201212.html