Шемелькова Г.О., Верховская А.Е., Соболева Г.Л.
ООО "Ветбиохим", г. Москва
Шемельков Е.В., Иванов Е.В., Непоклонова И.В.
АНО "Научно-исследовательский институт диагностики и
профилактики болезней человека и животных", г. Москва
Алипер Т.И. "НПО НАРВАК",
"ФГБУ НИИ вирусологии им. Д.И. Ивановского" МЗ РФ, г. Москва
Аденовирус крупного рогатого скота широко распространен среди поголовья и часто, в сочетании с другими вирусными агентами (вирусы инфекционного ринотрахеита, парагрип-па-3, вирусной диареи, респираторно-синцитиальным, рота- и коро-навирусами), является первопричиной возникновения и развития основных респираторных и кишечных инфекционных заболеваний телят, которые, в дальнейшем, осложняются вторичными инфекциями бактериальной этиологии [2, 5, 7, 10].
Установлено, что аденовирусы являются иммунодепрес-сантами и способствуют развитию других инфекционных патологий. Из-за сходства с другими инфекционными заболеваниями вирусной этиологии клинико-эпизоотологическая диагностика аденовирусной инфекции крупного рогатого скота затруднена [4].
Ввиду частой полиэтиологичности первичных вирусных инфекций и невозможности разграничения ведущей роли того или иного агента в развитии патологии, наиболее эффективным методом специфической профилактики таких заболеваний является применение комбинированных вакцин, содержащих антигены сразу всех или нескольких из указанных возбудителей [3, 7]. Вакцинации подвергают стельных коров для создания у новорожденного потомства пассивного колострального иммунитета, а также телят с 2-3-х недельного возраста для создания активного поствакцинального иммунитета [9].
В настоящее время имеется ряд поливалентных вакцин против двух, трех и более указанных респираторных и/или кишечных вирусных заболеваний телят, но отсутствуют зарегистрированные биопрепараты, предназначенные для специфической профилактики аденовирусной инфекции крупного рогатого скота. Однако, наряду с другими вирусными агентами, аденовирусы играют значительную роль в этиологии указанных заболеваний [1, 2, 8, 11].
В ранее проведенных исследованиях нам удалось выделить и идентифицировать методом секвенирования фрагмента генома аденовирус крупного рогатого скота I-го типа. Выделенный штамм аденовируса был адаптирован к перевиваемой культуре клеток и депонирован в государственной коллекции вирусов ФГБУ НИИ вирусологии им. Д.И. Ивановского МЗ РФ. В ходе проведенных исследований установили, что выделенный аденовирус обладает выраженными антигенными свойствами и пригоден для использования в составе инактивированных вакцин [6].
Целью настоящей работы была разработка комбинированной вакцины против аденовирусной инфекции, инфекционного ринотрахеита, парагриппа-3, вирусной диареи, респираторно-синци-тиальной, рота- и коронавирусной болезнях крупного рогатого скота, а также оценка эффективности ее применения в производственных условиях.
Материалы и методы. Для проведения серомониторинга использовали пробы сыворотки крови крупного рогатого скота, полученные из разных субъектов РФ, которые исследовали на наличие ви-руснейтрализующих антител к аденовирусу, вирусам инфекционного ринотрахеита, парагриппа-3, вирусной диареи, респираторно-синци-тиальному, рота- и коронавирусам крупного рогатого скота. Наличие специфических антител к возбудителям инфекционного ринотрахеита и респираторно-синцитиальной инфекции, так же определяли методом ИФА, с использованием соответствующих диагностических ИФА-наборов: "ИРТ-СЕРОТЕСТ" и "РСИ-СЕРОТЕСТ", производства ООО "Ветбиохим".
В качестве прототипа использовали инактивированную комбинированную вакцину "КОМБОВАК", производства ООО "Ветбиохим".
Экспериментальные образцы вакцины готовили из одной партии инактивированного аденовируса крупного рогатого скота I-го типа, штамм "Альфа" (выделен от 17-и суточного теленка) [6], а также инактивированных антигенов производственных штаммов вирусов инфекционного ринотрахеита, парагриппа-3, вирусной диареи, рес-пираторно-синцитиального, рота- и коронавирусов крупного рогатого скота.
При выборе адъюванта для вакцины провели исследования шести различных коммерческих и экспериментальных препаратов: ISA 50, ISA 71, ISA 206, ISA 773 (SEPPIC, Франция), адъювантный комплекс Акрум-С (комплекс высокомолекулярного синтетического полиэлектролита со смесью поверхностно-активных гликозидов), гель гидроокиси алюминия (ГОА). Соотношения антигенной части и адъюванта брали в пропорциях, рекомендованных производителем адъюванта или подбирали опытным путем.
В качестве лабораторной модели, для оценки безвредности использовали группы морских свинок и белых мышей (n = 5 и n = 10, соответственно, на каждый образец). Морским свинкам вакцину вводили внутримышечно в дозе 2,0 мл, белым мышам - подкожно в дозе 0,5 мл. За животными вели наблюдение в течение 15 суток.
Антигенную активность образцов на лабораторной модели, оценивали путем проведения однократной внутримышечной вакцинации группы морских свинок (n = 10, на каждый образец), сформированной по принципу аналогов в дозе 1,0 мл, с последующим исследованием сыворотки крови, полученной до и через 21 сутки после вакцинации, на наличие специфических антител в реакции нейтрализации (РН).
Безвредность и антигенную активность изготовленных образцов в опыте на естественно восприимчивых животных оценивали путем проведения двукратной внутримышечной иммунизации коров за 1-2 месяца до осеменения (n=30 на каждый образец вакцины), сформированных в соответствующие группы по принципу аналогов, в дозе 3,0 мл. Кровь брали выборочно по 10 голов из каждой группы перед вакцинацией (Д0) и через 21 сутки после первой (Д21) и второй иммунизаций (Д42), с последующим исследованием сыворотки крови по уровню специфических антител в РН.
Для определения оптимальной иммунизирующей дозы вакцины использовали три группы коров за 1-2 месяца до осеменения (n = 15 в каждой группе), которых иммунизировали внутримышечно двукратно с интервалом 21 сутки в дозах 2,0 мл (первую группу), 3,0 мл (вторую группу) и 4,0 мл (третью группу). А также две группы телят в возрасте 2,5-3 месяца (n = 15 в каждой группе), которых иммунизировали двукратно внутримышечно в дозах 1,0 мл (первую группу) и 2,0 мл (вторую группу). Кровь у животных брали перед вакцинацией (Д0) и через 21 сутки после второй иммунизаций (Д42), с последующим исследованием сыворотки крови по уровню специфических антител в РН. В качестве контроля использовали группы невакцинированных животных (по 10 голов коров и телят).
Постановку и учет результатов РН осуществляли по стандартным методикам с использованием соответствующих контрольных штаммов вирусов.
Оценку эффективности применения вакцины в производственных условиях проводили в животноводческом хозяйстве, неблагополучном по респираторным и кишечным инфекционным заболеваниям телят. В хозяйстве вакцинировали стельных коров - дважды: первый раз - за 50-60 суток до отела, второй - через 14-21 сутки в дозе 3,0 мл. Полученных телят первый раз вакцинировали в возрасте 25-30 суток, повторно через 20-25 суток в дозе 2,0 мл. В качестве контроля использовали группы невакцинированных стельных коров и телят, которые содержались в другом помещении. Эффективность применения вакцины определяли по эпизоотологическим показателям: заболеваемость телят респираторными и кишечными инфекциями, смертность телят, а также их вынужденная выбраковка в опытной и контрольной группах.
Статистическую обработку данных выполняли общепринятыми методами (компьютерные программы Microsoft Excel 2010, Stat Plus 2005).
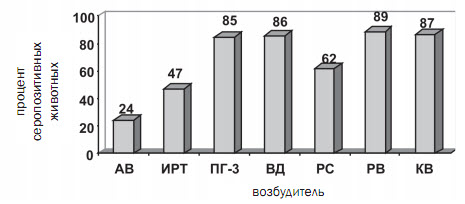
Результаты исследований. На первом этапе работы (20102012 г.) мы провели исследование 869 проб сыворотки крови коров и телят, полученных от невакцинированных животных, из 12 неблагополучных по основным респираторным и кишечным инфекционным заболеваниям хозяйств Вологодской, Воронежской, Калужской, Московской, Тамбовской областей, Алтайского и Краснодарского краев, Республики Башкирия. В ходе проведенного серомониторинга было выявлено наличие специфических антител к возбудителям: аденовирусной инфекции (АВ) в 24% исследуемых проб, инфекционного ринотрахеита (ИРТ) - в 47%, парагриппа-3 (ПГ-3) - в 85%, вирусной диареи (ВД) - в 86%, респираторно-синцитиальной болезни (РС) - в 62%, ротавирусной болезни (РВ) - в 89%, коронавирусной болезни (КВ) - в 87% исследуемых проб (рисунок 1).

Рис. 1. Количество положительных проб сыворотки крови крупного рогатого скота
к соответствующему вирусу (в процентах от общего числа исследованных)
Результаты проведенных исследований свидетельствуют о широком распространении аденовирусной инфекции крупного рогатого скота в животноводческих хозяйствах, при этом, в подавляющем большинстве случаев, она встречается в сочетании с другими вирусными заболеваниями. Таким образом, аденовирус крупного рогатого скота играет существенную роль в этиологии основных вирусных заболеваний телят. Полученные результаты согласуются с данными других ученых, показывающими широкое распространение вирусных инфекций, в том числе и аденовирусной, среди поголовья крупного рогатого скота [1, 2, 5].
Кроме того, при проведении серологических исследований, установлена корреляция результатов по выявлению антител к вирусам ИРТ и РС, полученных в РН и ИФА.
На основании проведенных исследований, с учетом имеющихся литературных данных, мы пришли к заключению о целесообразности создания комбинированной вакцины против основных респираторных и кишечных вирусных заболеваний телят, включающей в себя аденовирус крупного рогатого скота.
Поскольку, по сравнению с прототипной вакциной "КОМБОВАК", в новой вакцине увеличивается количество вирусных антигенов и, следовательно, снижается объемная доля каждого отдельного антигена, то для нее требуется более иммунологически эффективный адъювант, способный обеспечить выраженный иммунный ответ на каждый антиген.
В ходе данной работы исследовали шесть адъювантов, с которыми изготовили экспериментальные образцы вакцины. Оценку изготовленных образцов проводили по показателям безвредности и антигенной активности в опытах на лабораторных и естественно восприимчивых животных.
Изучение безвредности показало, что экспериментальные образцы вакцины не вызывали заболевания или гибели подопытных животных, при этом у отдельных особей наблюдали образование плотных ограниченных припухлостей на месте введения образцов с масляными адъювантами.
В опытах на лабораторных и естественно восприимчивых животных установлено, что введение экспериментальных образцов вакцины вызывало развитие выраженного иммунного ответа (Р < 0,01). При этом, разные типы адъювантов оказывали неодинаковый иммуностимулирующий эффект на организм подопытных животных, что выразилось в различном уровне содержания специфических антител, синтезирующихся в процессе поствакцинального иммуногенеза (табл. 1 и 2).
Таблица 1. Сравнительная оценка антигенной активности вакцины с разными адъювантами в опыте на лабораторных животных
| N° п/п | Адъювант | Титр антител к вирусу | ||||||
|---|---|---|---|---|---|---|---|---|
| АВ | ИРТ | ВД | ПГ-3 | РС | РВ | КВ | ||
| 1 | ГОА | 56 | 34 | 64 | 119 | 23 | 52 | 69 |
| 2 | Акрум-С | 74 | 49 | 97 | 137 | 26 | 104 | 60 |
| 3 | ISA 50 | 74 | 37 | 128 | 256 | 28 | 147 | 181 |
| 4 | ISA 71 | 56 | 37 | 74 | 274 | 34 | 137 | 128 |
| 5 | ISA 206 | 32 | 34 | 69 | 91 | 28 | 42 | 97 |
| 6 | ISA 773 | 42 | 42 | 111 | 119 | 37 | 111 | 128 |
Таблица 2. Сравнительная оценка антигенной активности вакцины с разными адъювантами в опыте на крупном рогатом скоте
| N° п/п | Адъювант | Срок исслед | Титр антител к вирусу | ||||||
|---|---|---|---|---|---|---|---|---|---|
| АВ | ИРТ | ВД | ПГ-3 | РС | РВ | КВ | |||
| 1 | ГОА | А0 | 0 | 8 | 11 | 8 | 0 | 17 | 18 |
| А21 | 42 | 32 | 79 | 147 | 23 | 64 | 128 | ||
| А42 | 74 | 45 | 128 | 208 | 52 | 256 | 111 | ||
| 2 | Акрум-С
| А0 | 0 | 4 | 8 | 6 | 0 | 13 | 21 |
| А21 | 45 | 52 | 97 | 158 | 32 | 128 | 137 | ||
| А42 | 84 | 79 | 137 | 223 | 64 | 294 | 119 | ||
| 3 | ISA 50 | А0 | 0 | 3 | 10 | 11 | 0 | 23 | 32 |
| А21 | 52 | 147 | 104 | 239 | 39 | 416 | 294 | ||
| А42 | 111 | 119 | 194 | 416 | 84 | 388 | 223 | ||
| 4 | ISA 71 | А0 | 0 | 7 | 9 | 11 | 0 | 18 | 16 |
| А21 | 49 | 97 | 128 | 446 | 39 | 446 | 362 | ||
| А42 | 104 | 64 | 239 | 362 | 79 | 338 | 239 | ||
| 5 | ISA 206
| А0 | 0 | 2 | 17 | 13 | 0 | 26 | 28 |
| А21 | 26 | 28 | 64 | 119 | 28 | 128 | 97 | ||
| А42 | 52 | 39 | 74 | 181 | 52 | 111 | 104 | ||
| 6 | ISA 773
| А0 | 0 | 8 | 13 | 16 | 0 | 20 | 26 |
| А21 | 42 | 79 | 119 | 239 | 28 | 148 | 147 | ||
| А42 | 91 | 56 | 223 | 294 | 74 | 170 | 111 | ||
Результаты, представленные в таблицах 1 и 2, свидетельствуют о том, что самой высокой антигенной активностью в опытах на лабораторных и естественно восприимчивых животных обладали образцы вакцины, изготовленные на основе адъювантов ISA 50 и ISA 71. Остальные экспериментальные образцы были менее эффективны.
На основе анализа полученных данных, а также ряда дополнительных показателей, в качестве адъюванта для изготовления вакцины был выбран масляный адъювант ISA 50.
Опыты по определению оптимальной иммунизирующей дозы вакцины показали, что введение препарата коровам в дозах 2,0, 3,0 и 4,0 мл, телятам - в дозах 1,0 и 2,0 мл вызывает у животных развитие выраженного гуморального иммунного ответа. При этом объем дозы препарата, вводимой животным, оказывал существенное влияние на уровень образования антител в процессе поствакцинального иммуногенеза (табл. 3).
Таблица 3. Определение оптимальной иммунизирующей дозы вакцины
| Доза | Срок исслед. | Титр антител к вирусу | ||||||
|---|---|---|---|---|---|---|---|---|
| ИРТ | ВД | ПГ-3 | РС | РВ | КВ | АВ | ||
| коровы | ||||||||
| 2,0 мл | А0 | 3 | 36 | 41 | 0 | 23 | 32 | 5 |
| А42 | 75 | 124 | 209 | 47 | 124 | 111 | 65 | |
| 3,0 мл | А0 | 2 | 42 | 28 | 0 | 26 | 28 | 6 |
| А42 | 119 | 239 | 416 | 96 | 388 | 239 | 109 | |
| 4,0 мл | А0 | 6 | 29 | 33 | 0 | 31 | 18 | 4 |
| А42 | 100 | 198 | 401 | 85 | 390 | 218 | 115 | |
| Контрольная группа | А0 | 8 | 13 | 16 | 0 | 20 | 26 | 5 |
| А42 | 2 | 17 | 13 | 0 | 26 | 28 | 8 | |
| телята | ||||||||
| 1,0 мл | А0 | 8 | 48 | 37 | 0 | 20 | 26 | 6 |
| А42 | 128 | 192 | 156 | 51 | 118 | 86 | 123 | |
| 2,0 мл | А0 | 2 | 56 | 32 | 0 | 26 | 28 | 5 |
| А42 | 256 | 321 | 304 | 120 | 224 | 119 | 217 | |
| Контрольная группа | А0 | 4 | 53 | 37 | 0 | 24 | 32 | 3 |
| А42 | 16 | 78 | 45 | 0 | 18 | 44 | 7 | |
По результатам, приведенным в таблице 3, можно сделать выводы о том, что наиболее оптимальным объемом вакцины, вводимой коровам, является доза 3,0 мл. Введение вакцины в объеме 2,0 мл вызывало формирование менее напряженного гуморального иммунного ответа, в то время как увеличение объема вводимой вакцины до 4,0 мл не вызывало достоверного увеличения уровня поствакцинальных вируснейтрализующих антител в сыворотке крови вакцинированных животных. Увеличение в два раза дозы вакцины, вводимой телятам, привело к повышению уровня синтезируемых антител ко всем вирусным компонентам, в среднем, в 1,83 раза.
Таким образом, на основании проведенных исследований было установлено, что оптимальная иммунизирующая доза вакцины для коров составляет 3,0 мл, для телят - 2,0 мл.
Оценку эффективности инактивированной вакцины против аденовирусной инфекции, инфекционного ринотрахеита, парагриппа-3, вирусной диареи, респираторно-синцитиальной, рота- и коронави-русной болезней крупного рогатого проводили в производственных условиях животноводческого хозяйства, неблагополучного по респираторным и кишечным инфекционным заболеваниям телят.
Для этого была изготовлена экспериментальная серия вакцины, которая перед отправкой в хозяйство прошла лабораторные испытания по показателям: стерильность, безвредность и антигенная активность.
В хозяйстве всего было вакцинировано 376 стельных коров и 370 телят, полученных от вакцинированных животных. В качестве контроля использовали невакцинированных стельных коров (n=243) и телят (n=238), которых содержали в другом помещении.
В ходе проведения испытаний по оценке эффективности применения вакцины в производственных условиях были получены следующие результаты: в опытной группе заболеваемость телят составила 21 %, смертность и вынужденная выбраковка 2,9 %, в то время как в контрольной группе данные показатели составили 65 % и 9 % , соответственно (рисунок 2).
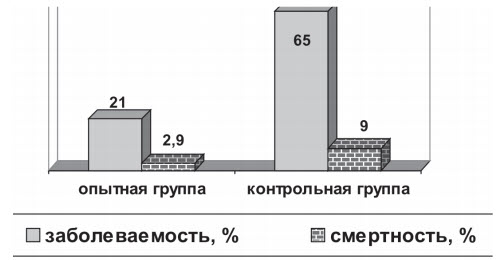
Рис. 2. Эффективность применения вакцины в хозяйстве
Таким образом, в результате проведенных исследований была показана практическая эффективность разработанной вакцины против основных вирусных респираторных и кишечных инфекций крупного рогатого скота.
Заключение. Результаты проведенного серомониторинга ряда животноводческих хозяйств восьми субъектов РФ показали, что аденовирус крупного рогатого скота играет важную роль в этиологии респираторных и кишечных болезней телят наряду с другими вирусными агентами. Наиболее эффективным средством специфической профилактики таких заболеваний является применение комбинированных вакцин. При разработке вакцины был подобран оптимальный состав вирусных компонентов и выбран эффективный масляный адъювант.
На основании результатов проведенных исследований была установлена оптимальная иммунизирующая доза вакцины, объем которой составляет для взрослых животных - 3,0 мл, для телят - 2,0 мл.
При проведении производственных испытаний было показано, что разработанная комбинированная вакцина, содержащая аденовирусный компонент, является безопасным и высокоэффективным препаратом.
Список литературы:
Резюме.
В работе показана широкая распространенность аденовирусной инфекции, что послужило обоснованием необходимости создания комбинированной семикомпонентной вакцины против вирусных болезней крупного рогатого скота, включающей аденовирус КРС. Проведены исследования по подбору оптимального соотношения компонентов в вакцине, а так же сравнительная оценка безвредности и эффективности шести разных адъюван-тов. По результатам опытов, проведенных на лабораторных и естественно восприимчивых животных, для изготовления вакцины выбран масляный адъювант. Экспериментальным путем установлены оптимальные иммунизирующие дозы вакцины для взрослых животных и телят.
Показана высокая эффективность применения разработанной вакцины в условиях животноводческого хозяйства для профилактики основных респираторных и кишечных инфекционных заболеваний телят.
Ключевые слова: аденовирус, вирусные инфекции, крупный рогатый скот, адъюванты, вакцина, антигенная активность, эффективность, профилактика.
Сведения об авторах:
Шемелькова Галина Олеговна, биотехнолог отдела контроля качества ООО "Ветбиохим"; 123098, г. Москва, ул. Гамалеи, 16; 8 (495) 193-54-93; e-mail: shemelckova@yandex.ru .
Верховская Анна Евгеньевна, кандидат ветеринарных наук, заместитель начальника отдела контроля качества ООО "Ветбиохим"; 123098, г. Москва, ул. Гамалеи, 16; 8 (495) 193-54-93; e-mail: averkchovskay@mail.ru.
Иванов Евгений Валерьевич, кандидат биологических наук, ведущий научный сотрудник АНО "НИИ ДПБ"; 123098, г. Москва, ул. Гамалеи, 16; 8 (499) 190-75-61; e-mail: doctor2112@yandex.ru.
Соболева Галина Леонидовна, доктор биологических наук, начальник отдела контроля качества ООО "Ветбиохим"; 123098, г. Москва, ул. Гамалеи, 16; 8 (495) 193-54-93; e-mail: gsoboleva@rosvet.ru.
Непоклонова Ирина Владимировна, кандидат ветеринарных наук, заведующая отделом диагностики и профилактики вирусных болезней АНО "НИИ ДПБ"; 123098, г. Москва, ул. Гамалеи, 16 8 (499) 190-75-61; e-mail: info@dpri.ru.
Алипер Тарас Иванович, доктор биологических наук, профессор, генеральный директор "НПО НАРВАК"; заведующий отделом прикладной вирусологии и биотехнологии "ФГБУ НИИ вирусологии им. Д.И. Ивановского" МЗ РФ; 123098, г. Москва, ул. Гамалеи, 16; 8 (499) 190-30-54; e-mail: aliper@narvac. com.
Ответственный за переписку с редакцией: Шемельков Евгений Владимирович, кандидат ветеринарных наук, ведущий научный сотрудник АНО "НИИ ДПБ"; 123098, г. Москва, ул. Гамалеи, 16; 8 (499) 190-75-61; e-mail: shemelkov@mail.ru.
UDС 636.028:57.083
SPECIFIC PREVENTION OF ADENOVIRAL INFECTION OF CATTLE WITH COMBINED VACCINE
Shemelkovа G.O., Verkhovskaya A.E., Soboleva G.L., Shemelkov E.V., Ivanov E.V., Nepoklonova I.V., Aliper T.I.
Summary.
According to the monitoring of serum samples presence of specific antibodies to bovine adenovirus was revealed in 24% of samples, suggesting widespread of adenovirus infection. For the prevention of major respiratory and enteric diseases of calves seven-component combined vaccine including bovine adenovirus type 1 has been developed. Vaccine has been successfully tested in cattle farms with major infectious diseases of calves.
Key words: adenovirus, viral infections, cattle, adjuvants, vaccine, antigene activity, efficiency, prevention. References:
Author affiliation:
Shemelkova Galina O., biotechnologist of the department of quality control of the Vetbiochem LLC; 16, Gamaleya st., Moscow, 123098; phone: +7 (495) 193-54-93; e-mail: shemelckova@yandex.ru.
Verkhovskaya Anna E., Ph.D. in Veterinary Medicine, deputy chief of the department of quality control of the Vetbiochem LLC; 16, Gamaleya st., Moscow, 123098; phone: +7 (495) 193-54-93; e-mail: averkchovskay@mail.ru.
Soboleva Galina L., D.Sc. in Biology, head of the department of quality control of the Vetbiochem LLC; 16, Gamaleya st., Moscow, 123098; phone: +7 (495) 193-54-93; e-mail: gsoboleva@rosvet.ru.
Ivanov Evgeny V., Ph.D. in Biology, leading scientific researcher of the Diagnostic and Prevention Research Institute for Human and Animal Diseases; 16, Gamaleya st., Moscow, 123098; phone: +7 (499) 190-75-61; e-mail: doctor2112@yandex.ru.
Nepoklonova Irina V., Ph.D. in Veterinary Medicine, manager of the department of diagnostics and prevention of virus diseases of the Diagnostic and Prevention Research Institute for Human and Animal Diseases; 16, Gamaleya st., Moscow, 123098; phone: +7 (499) 190-75-61; e-mail: info@dpri.ru.
Aliper Taras I., D.Sc. in Biology, professor, director of the NARVAC Ltd; head of the department of applied virology and biotechnology of Ivanovsky Research Institute of Virology; 16, Gamaleya str., Moscow, 123098; phone: +7 (499) 190-30-54; e-mail: aliper@narvac.com.
Responsible for correspondence with the editorial board: Shemelkov Evgeny V., Ph.D. in Veterinary Medicine, leading scientific researcher of the Diagnostic and Prevention Research Institute for Human and Animal Diseases (DPRI); 16, Gamaleya st., Moscow, 123098; phone: +7 (499) 190-75-61; e-mail: shemelkov@mail.ru.
http://vetkuban.com/num3_201211.html