УДК 619:616.98:579.869.2
Кузьменко М.А., Цатурян Л.Г., Скляров О.Д. Федеральное государственное бюджетное учреждение
«Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов», г. Москва
Черных О.Ю., Кривонос Р.А. Федеральное государственное бюджетное образовательное учреждение высшего
образования «Кубанский государственный аграрный университет имени И.Т. Трубилина», г. Краснодар
Басанкин А.В. департамент ветеринарии Краснодарского края, г. Краснодар
Совершенствование контроля иммуногенных свойств вакцин против рожи свиней имеет важное значение, так как способствует внедрению в практику эффективных иммунобиологических лекарственных средств [1, 3].
Проблемы применения живых вакцин обусловлены тем, что с целью профилактики и лечения желудочно-кишечных болезней у молодняка свиней применяют антибиотики или другие противомикробные средства, которые отрицательно влияют на формирование поствакцинального иммунитета. Причем, широкое применение антибиотиков приводит к формированию антибиотикорезистентных бактерий, остаточная вирулентность которых не известна [6].
Хотя следует учитывать, что применение антибиотиков не столь выраженно, но также отражается на продолжительности и напряженности иммунного ответа у свиней, вакцинированных инактивированными вакцинами [4, 5].
Следует отметить, что на сегодняшний день в мире не выработано единого подхода по проведению контроля иммуногенной активности указанных препаратов. Так, за рубежом контроль специфической активности инактивированных вакцин против рожи свиней оценивают по результатам определения количества антигена бактерий вакцинного штамма методом иммуноферментного анализа (далее, ИФА), или путем определения уровня антител в сыворотке крови вакцинированных белых мышей методом ИФА [2]. Исходя из этого нами предложена методика определения качества вакцины против рожи свиней по показателю «иммуногенная активность».
С учетом вышеизложенного цель исследования, состоящую в сравнительной оценке и разработке методик проведения контроля иммуногенной активности живых и инактивированных вакцин против рожи свиней, следует считать актуальной.
Материалы и методы исследований. В работе использовали живые и инактивированные вакцины против рожи свиней отечественных и зарубежных производителей. Всего для испытания были выбраны 9 вакцин разных производителей:
Исследование вакцин проводили параллельно согласно Европейской Фармакопее 0064 «Вакцина против рожи (инактивированная) для свиней (Swine erysipelas vaccine (inactivated))» пункт 2-1-2 «Иммуногенность» в нашей редакции, Европейской фармакопее 0064 пункт 2-2-1 по показателю «Испытание активности серии» методом ИФА с использованием наборов разных производителей, а также в «Тесте защиты иммунизированных мышей от заражения культурой вирулентного штамма».
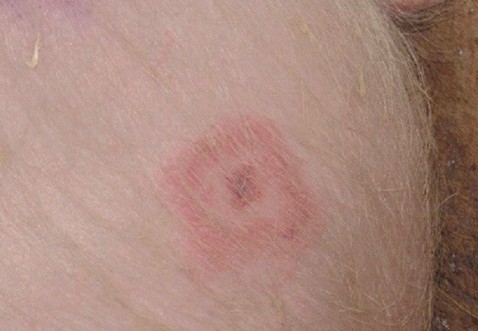
Для определения показателя «Иммуногенность» поросят весом не менее 20 кг и возраста не менее 12 недель отобрали в группы по 8 голов в каждой. Животных в каждой из групп подразделили на две подгруппы по 5 и 3 головы в каждой. По 5 голов животных каждой подгруппы иммунизировали одной из испытуемых вакцин, в установленной дозе, согласно инструкциям по их применению. Соответственно, по 3 головы контрольных животных в подгруппах не иммунизировали. Спустя 3 недели всех иммунизированных и не иммунизированных животных заразили внутрикожно суспензией бульонной культуры штамма Erysipelothrix rhusiopathiae 149. Концентрацию микробных клеток в суспензии заражающей культуры определяли с помощью спектрофотометра УФ-3000 (Ecoview). Показатель ОП составил 23±2%, что соответствовало 562-735 млн КОЕ/см3. Суспензию бульонной культуры разбавили физиологическим раствором из расчета 1:10 и вводили свиньям в дозе от 5,62 до 7,35 млн или 6±1 млн живых микробных клеток в 0,1 см3. Вакцину оценивали, как иммуногенную, если не менее чем у четырех вакцинированных свиней не наблюдали проявления клинических признаков болезни в виде формирования розово-красных ромбовидных поражений кожи в местах инъекции и при наличии не менее чем у 2-х свиней контрольной группы типичных признаков болезни (рисунок 1).

Рис. 1. Поражение кожи поросенка после заражения штаммом Erysipelothrix rhusiopathiae 149
Таблица 1 Результаты сравнительного испытания вакцин или их компонентов против рожи свиней по показателю «иммуногенная активность»
| № | Наименование испытуемых вакцин | «Иммуногенность» ЕФ 0064 пункт 2-1-2 | Метод фирмы-производителя или ЕФ 0064 пункт 2-2-1 | «Тест защиты вакцинированных мышей от заражения культурой вирулентного штамма» | ||
|---|---|---|---|---|---|---|
| Поросята | Выжило, % | Пало, % | ||||
| Вакцинированные | Контрольные | |||||
| 1 | Вакцина против рожи свиней из штамма «ВР-2» живая сухая | - | + | Вакцина иммуногенная. Через 4 суток после заражения 10 из 10 вакцинированных белых мышей остались живыми, а 10 из 10 не вакцинированных (контрольных) погибли. | 100 | 0 |
| 2 | Вакцина против рожи и парвовирусной болезни свиней инактивированная - «Верес-ЭП» | + | + | Вакцина активная. Через 7 суток после заражения 10 из 10 неиммунизированных белых мышей (контрольных) погибли, а 9 из 10 иммунизированных белых мышей остались живыми. | 80 | 20 |
| 3 | Вакцина против рожи свиней инактивированная - Эрисенг | - | + | Вакцина иммуногенная RP=4,83 | 100 | 0 |
| 4 | Вакцина против парвовирусной инфекции и рожи свиней инактивированная - Эрисенг/ Парво | - | + | Вакцина иммуногенная RP=4,93 (Нормативное значение > 3,34 ) | 100 | 0 |
| 5 | Вакцина против рожи свиней инактивированная - Порцилис Ery | - | + | Вакцина иммуногенная RP=2,77 (Нормативное значение RP >1) | 100 | 0 |
| 6 | Вакцина против рожи и парвовирусной инфекции свиней инактивированная - Порцилис Ery+Parvo | + | + | Вакцина не иммуногенная RP=0,58 (Нормативное значение RP >1) | 20 | 80 |
| 7 | Вакцина против рожи, парвовирусной инфекции и лептоспироза свиней инактивированная - | - | + | Вакцина иммуногенная RP=2,72 (Нормативное значение RP >1) | 100 | 0 |
| 8 | Вакцина против парвовироза и рожи свиней инактивированная - «Парворувакс» | - | + | Вакцина иммуногенная RP=3,63 (Нормативное значение RP >1) | 100 | 0 |
| 9 | Вакцина против парвовироза, рожи и лептоспироза свиней - «Фарошур Голд В» | - | + | Вакцина иммуногенная R=48,9 (Нормативное значение R >1) | 100 | 0 |
Примечание: «+» - выявлены клинические признаки болезни; «-» - не выявлены клинические признаки болезни
При выполнении контроля испытуемых серий вакцин по показателю «Активность серии» использовали по 10 белых мышей весом 17-20 граммов, которых вакцинировали подкожно 1/10 дозы для свиней. Через 28 дней после вакцинации мышей обескровили под наркозом и получили объединенные образцы сыворотки крови от животных, иммунизированных соответствующей вакциной. Количество антител в образцах сыворотки определяли методом ИФА.
С целью испытания образцов каждой серии вакцины в соответствии с предложенной нами методикой «Тест защиты вакцинированных мышей от заражения культурой вирулентного штамма» белые мыши массой 17-20 граммов были сформированы в группы по 10 голов в каждой. Испытуемые вакцины вводили животным подкожно из расчета 1/10 дозы для свиней, в соответствии с инструкцией фирмы-производителя.
В качестве контроля использовали 10 голов мышей, иммунизированных стандартными вакцинами (прошедшими контроль качества по показателю иммуногенная активность на поросятах) и 10 голов неиммунизированных мышей.
Спустя 28 дней после вакцинации всех мышей заражали подкожно суспензией лиофилизированной культуры штамма Erysipelothrix rhusiopathiae 149 в дозе 100 LD50 в объеме 0,1 мл.
Вакцину считали выдержавшей испытание если 100% вакцинированных белых мышей оставались живыми по истечении семи дней наблюдения после заражения культурой контрольного вирулентного штамма при условии гибели 100% белых мышей контрольной группы.
Вакцина против рожи свиней инактивированная «Эрисенг» и вакцина против парвовирусной инфекции и рожи свиней инактивированная «Эрисенг/ Парво» по показателю «активность» оценивали методом ИФА путем определения количества содержащегося в них антигена согласно НД производителя.
Контроль качества вакцины «Верес-ЭП» против рожи и парвови-русной болезни свиней инактивированной и вакцины против парво-вироза, рожи и лептоспироза свиней «Фарошур Голд В» по показателю «активность» проверяли согласно НД производителей с помощью методики «вакцинация-заражение» белых мышей, согласно которым дозы вакцины и заражающей культуры, а также критерии оценки были разные и отличались от выбранной нами методики.
Для обработки полученных данных методом вариационной статистики использовали Microsoft Excel 2016.
Результаты исследований и их обсуждение. Результаты исследований представлены в таблице 1.
Как видно из данных таблицы при сравнительной оценке результатов исследований, полученных при испытании вакцин в разных тестах наблюдалось наличие строгой закономерности при их интерпретации. Так, результаты контроля вакцин по показателю «иммуногенная активность», подтверждающего их качество, совпадали с результатами испытания вакцин в «тесте защиты вакцинированных мышей от заражения культурой вирулентного штамма» и при оценке вакцин по показателю «активность». Результаты испытания вакцины против рожи и парвовирусной болезни свиней инактивированной «Верес-ЭП» подтвердили несоответствие требованиям качества по показателю «иммуногенность» Европейской Фармакопеи 0064 пункт 2-1-2 и в «тесте защиты вакцинированных мышей от заражения культурой вирулентного штамма». Вакцина против рожи и парвовирус-ной инфекции свиней инактивированная «Порцилис Ery+Parvo» не соответствовала по качеству требованиям всех тестов, используемых в исследованиях.
Заключение. Таким образом, результаты настоящего исследования позволяют утверждать, что предложенная нами методика по чувствительности и специфичности не отличается от методик, представленных в ЕФ. Как правило 1/10 доза вакцины для свиней должна предохранять от гибели 100% контрольных белых мышей для стандартной (прошедшей контроль качества по показателю иммуногенная активность на поросятах) и испытуемой вакцины при заражении суспензией лиофилизированной культуры штамма Erysipelothrix rhusiopathiae 149 в дозе 100 LD50 в объеме 0,1 мл. Считаем возможным включить методику «Тест защиты вакцинированных мышей от заражения культурой вирулентного штамма» в ГОСТ 28333-89 «Вакцина живая сухая против рожи свиней из штамма ВР-2» с целью контроля качества инактивированных вакцин как отечественных, так и зарубежных производителей без использования целевых видов животных и проведения ИФА.
Список литературы:
Резюме. Применение антибиотиков для профилактики болезней бактериальной этиологии у молодняка свиней приводит к снижению поствакцинального иммунного ответа организма животных, особенно в случае иммунизации живыми вакцинами против рожи. Это обусловливает все более возрастающее применение инактивированных противорожистых вакцин. С учетом того, что для контроля качества вакцин против рожи по показателю «иммуногенная активность» не выработано единого подхода авторами было проведено сравнительное испытание методик оценки специфической активности вакцин против рожи свиней согласно ЕФ 0064, а также нормативным документам (НД) фирм-производителей и предложенной методики «Тест защиты вакцинированных мышей от заражения культурой вирулентного штамма». Согласно результатам испытания 1/10 доза вакцины для свиней, как правило, предохраняла от гибели 100% контрольных белых мышей, иммунизированных стандартной (прошедшей контроль качества по показателю иммуногенная активность на поросятах) и испытуемой вакциной при заражении суспензией лиофилизированной культуры штамма Erysipelothrix rhusiopathiae 149 в дозе 100 LD50 в объеме 0,1 мл. Причем несоответствие отдельных вакцин требованиям НД было подтверждено результатами контроля всех тестов. Таким образом, результаты настоящего исследования позволяют заключить, что используемые в работе тесты не различаются по диагностической чувствительности и специфичности и, соответственно, «Тест защиты вакцинированных мышей от заражения культурой вирулентного штамма» может использоваться при контроле качества вакцин против рожи свиней.
Ключевые слова: свиньи, рожа свиней, иммунитет, вакцина, антитела, антиген, вирулентный штамм, иммуноферментный анализ, белые мыши, диагностическая чувствительность, иммуногенность.
Сведения об авторах:
Кузьменко Мария Анатольевна, младший научный сотрудник отдела бактериологии ФГБУ «ВГНКИ»; 123022, г. Москва, Звенигородское шоссе, 5; тел.: 8-915-4205878; e-mail: kuzmenko.m.a@bk.ru.
Цатурян Лусине Гамлетовна, кандидат ветеринарных наук, доцент, заместитель заведующего отдела бактериологии ФГБУ «ВГНКИ»; 123022, г. Москва, Звенигородское шоссе, 5; тел.:8-925-2712044; e-mail: lousine23@yandex.ru.
Скляров Олег Дмитриевич, доктор ветеринарных наук, заведующий лабораторией качества и стандартизации бактерийных лекарственных средств ФГБУ «ВГНКИ»; 123022, г. Москва, Звенигородское шоссе, 5; тел.: 8-916-2716154; e-mail: scliarov@yandex.ru.
Черных Олег Юрьевич, доктор ветеринарных наук, профессор кафедры микробиологии, эпизоотологии и вирусологии ФГБОУ ВО «Кубанский государственный аграрный университет имени И.Т. Трубилина»; 350044, г. Краснодар, ул. Калинина, 13; тел.: 8-918-4956659; e-mail: gukkvl50@kubanvet.ru.
Кривонос Роман Анатольевич, кандидат ветеринарных наук, доцент кафедры паразитологии, ветсанэкспертизы и зоогигиены ФГБОУ ВО «Кубанский государственный аграрный университет имени И.Т. Трубилина»; 350044, г. Краснодар, ул. Калинина, 13; e-mail: uv@krasnodar.ru.
Ответственный за переписку с редакцией: Басанкин Алексей Вадимович, кандидат ветеринарных наук, начальник отдела оперативного реагирования при возникновении заразных и иных болезней животных департамента ветеринарии Краснодарского края; 350000, г. Краснодар, ул. Рашпилевская, 36; тел.: 8-918-9550057; e-mail: abasankin@mail.ru.
http://vetkuban.com/num2_202205.html