УДК 636.92; 636.934.571
DOI 10.33861/2071-8020-2021-2-40-44
Попов Д.В., Косовский Г.Ю. Федеральное государственное бюджетное научное учреждение
«Научноисследовательский институт пушного звероводства и кролиководства имени В.А. Афанасьева»,
Московская обл., Раменский р-он, пос. Родники
Введение. Индукция суперовуляции (далее, ИС) является основным способом вызывания множественного роста фолликулов у самок млекопитающих для получения ооцитов или эмбрионов. Проведение процедуры ИС у самок млекопитающих заключается во введении препаратов, содержащих гонадотропины, в концентрациях превышающих физиологический эндогенный уровень. Наиболее используемыми на практике по эффективности ИС являются препараты, содержащие гонадотропины гипофизарного происхождения, - фолликулостимулирующий гормон (далее, ФСГ) и лютеинизирующий гормон (далее, ЛГ) [12, 15]. При этом ФСГ вызывает и стимулирует рост и созревание фолликулов в яичниках, а ЛГ инициирует, в последующем, их овуляцию [14]. Соотношение ФСГ/ЛГ имеет большое значение для проведения качественной индукции суперовуляции [5, 6, 14]. В настоящее время получают ФСГ и ЛГ из гипофиза животных (свиней, овец) или рекомбинантным способом [1, 7]. В отличие от гонадотропных препаратов, полученных, например, из сыворотки крови жеребых кобыл, гипофизарные гонадотропины имеют короткий период полувыведения, не вызывают необратимых изменений в структуре яичников, сохраняют воспроизводительную функцию самки после проведения процедуры ИС, сохраняют чувствительность яичников к вводимым гонадотропинам, не вызывают аллергических реакций [10]. В то же время короткий период катаболизма обуславливает, что при проведении индукции суперовуляции в лютеальную фазу полового цикла самкам млекопитающим необходимо обеспечить 8-10-кратное введение активных веществ ФСГ и ЛГ каждые 12 часов в течение 3-5 дней [7, 11]. Данный период времени (3-5 дней) является типичным для полного созревания множества фолликулов с образованием полноценных качественных яйцеклеток практически для всех видов млекопитающих, при условии введения экзогенных гонадотропинов в лютеальную фазу эстрального цикла [6, 12, 13]. Такой режим введения препаратов необходим для постоянного поддержания эффективного уровня гормона в крови, обеспечивающего рост и созревание множественного количества фолликулов [6, 11]. Недостатком многократного введения является трудоемкость процесса, требующего фиксации животного и введения ему препарата, четкого соблюдения временных интервалов между инъекциями. При этом появляются условия для колебания концентрации вводимых гонадотропинов в сыворотке крови животного и, как следствие, возникают предпосылки к получению низкого эффекта ИС. Альтернативой многократному введению препаратов, содержащих гипофизарные гонадотропины, является их применение в сочетании с пролонгатора-ми [2, 3, 9], которые бы позволили сократить количество инъекций и обеспечить постоянный уровень концентрации гонадотропных гормонов в крови самок-доноров эмбрионов при индукции суперовуляции [5, 8].
В этой связи целью наших исследований стало изучение гонадотропных профилей крови крольчих при различных протоколах введения высоких доз экзогенных гипофизарных гонадотропинов с целью индукции суперовуляции.
Материалы и методы исследований. Для освоения и совершенствования методов индукции суперовуляции у крольчих нами проведены процедуры введения гипофизарных гонадотропинов как по стандартным протоколам, так и протоколам с однократной инъекцией гипофизарных гонадотропинов с пролонгированным высвобождением (табл. 1). С этой целью сформированы 4 экспериментальные группы, состоящие из 5 крольчих каждая (n = 5*4=20), в возрасте 5-6 месяцев. Для индукции суперовуляции применяли полученный из свиного гипофиза препарат ФСГ-супер в дозе 66 МЕ для одной самки.
Для стабильного высвобождения гипофизарных гонадотропинов применяли препарат ФСГ-супер в сочетании с поливиниловым спиртом (ПВС) и полиэтиленгликолем (ПЭГ).
Для проведения процедур искусственного осеменения использовали свежеполученную сперму от самцов кроликов. Сперму получали с использованием искусственной вагины. Полученную сперму оценивали под микроскопом с увеличением 200-400 крат и разбавляли в 10 раз средой «Galap» (IMV) для спермы кроликов. Процедуру искусственного осеменения проводили однократно.
Так как кролики относятся к млекопитающим с индуцированной овуляцией, то для овуляции созревших фолликулов сразу после процедуры искусственного осеменения в ушную вену вводили 100 МЕ человеческого хорионического гонадотропина. Учёт реакции проводили через 66-72 часов после осеменения. Для этого всех крольчих подвергли оперативному вмешательству - лапаротомии.
Таблица 1 Протоколы введения гонадотропинов крольчихам с целью индукции суперовуляции
| День исследования/ процедура | Группа | |||
|---|---|---|---|---|
| I | II | III | IV | |
| Классический протокол индукции СО препаратом ФСГ- супер (n=5) | Однократная инъекция ФСГ-супер с ПВС (n=5) | Однократная инъекция ФСГ-супер с ПЭГ (n=5) | Контроль (n=5) | |
| 1 день - индукция СО | Инъекция ФСГ супер У: 15 МЕ в/м В: 15 МЕ в/м | Инъекция ФСГ супер 66 МЕ в/м | Инъекция ФСГ супер 66 МЕ в/м | - |
| 2 день - индукция СО | Инъекция ФСГ супер У: 10 МЕ в/м В: 10 МЕ в/м | - | - | - |
| 3 день - индукция СО | Инъекция ФСГ супер У: 8 МЕ в/м В: 8 МЕ в/м | - | - | - |
| 4 день - ИО, индукция овуляции | Искусственное осеменение Инъекция ЧХГ 100 МЕ в/в | Искусственное осеменение | Искусственное осеменение | Искусственное осеменение Инъекция ЧХГ 100 МЕ в/в |
| 7 день - лапаротомия, учёт реакции | Лапаротомия, учёт реакции | Лапаротомия, учёт реакции | Лапаротомия, учёт реакции | Лапаротомия, учёт реакции |
Примечание: У - утро, В - вечер
Для внутривенного доступа перед проведением лапаротомии крольчихам в ушные вены были установлены периферические венозные катетеры диаметров 20G, 22G, 24G. Поскольку оперативное вмешательство было непродолжительным, в качестве наркоза использовали Пропофол 20% внутривенно. Препарат дозировали индивидуально по рефлексам, из расчёта изначальной дозы 7.5-15 мг/кг (Carpenter, 2012). Операционное поле после выбривания шерсти обрабатывали по Филончикову-Гроссиху и изолировали с помощью нетканой одноразовой салфетки и цапок. Животное фиксировали на операционном столе, на спине. Хирургический доступ проводили сагиттально, по белой линии живота, на 2-3 см ниже пупка. Возникающие кровотечения из сосудов кожи, подкожной жировой клетчатки и брюшной стенки устраняли электрокоагуляцией. Для предупреждения пересыхания внутренние органы, орошали стерильным тёплым физиологическим раствором. Через разрез в брюшной стенке находили рог матки, который извлекали сначала вентрально, до тех пор, пока над поверхностью кожи не покажется яичник, затем латерально на поверхность нетканого материала. Во избежание травмирования рога матки металлическим инструментом, он удерживался мануально.
Для учета реакции определяли макроморфологические параметры яичников штангенциркулем и визуально определяли количество жёлтых тел и неовулировавших фолликулов.
Для проведения исследования уровней содержания гонадотропных гормонов в крови крольчих-доноров в период индукции суперовуляции осуществляли забор крови в группах II - IV в течение 4 суток с интервалом 12 часов, первую пробу получали перед введением препарата. В группе I, где применяли классический режим введения препарата ФСГ-супер, последующие пробы крови отбирали за 3 часа до инъекции гонадотропина и через 3 часа после его введения, также в течение 4 суток с интервалом 12 часов. Кровь отбирали из ушной вены в пробирки с активатором свёртывания и ставили в холодильник, через 12 часов отбирали сыворотку. Определение концентрации ФСГ и ЛГ в сыворотке крови проводили на анализаторе иммуноферментных реакций (ИФА анализатор Multiskan FC) с применением тест-систем: «Гонадотропин ИФА-ЛГ», «ФСГ-свиньи-ИФА» ООО «Диатех-ЭМ».
При проведении исследования соблюдали принципы биоэтики и гуманного обращения с лабораторными животными [4].
Статистическая обработка проведена в программе MS EXCEL, для статистической обработки использовали t-критерий Стьюдента.
Результаты исследований и их обсуждение. Результаты индукции суперовуляции у крольчих при разных протоколах введения гонадотропинов представлены в таблице 2. По показанным данным видно, что при индукции суперовуляции соответственно протоколу введения препарата ФСГ-супер в виде однократной инъекции, содержащей полную дозу гонадотропинов в составе фармацевтической композиции с добавлением полимера ПЭГ, наиболее выраженная реакция отмечается в группе III, проявляющаяся в общей реакции яичников, среднее значение количества созревших фолликулов на самку составило 38,2±3,83, при этом была установлена статистически значимая разница (p<0,001) относительно контрольной группы, и средние размеры яичников в этой группе доноров составили: левый яичник - 22±0,7 х 6,0±1,0 мм и правый яичник - 22,2±0,83 х 6,2±0,83 мм. Относительно группы II, статистически значимых отличий установлено не было, в то же время прослеживалась тенденция к увеличению значений показателей ИС.
Таблица 2 Результаты индукции суперовуляции у крольчих при разных протоколах введения гонадотропинов
| Показатели, в среднем на самку в группе | Группа I | Группа II | Группа III | Группа IV |
|---|---|---|---|---|
| Общая реакция яичников (созревших фолликулов | 28,8±5,31** | 33,2±4,32*** | 38,2±3,83*** | 11,2±1,48**,*** |
| Количество жёлтых тел, (%) | 22,8±3,4** | 31,0±2,7*** | 37,4±3,0*** | 10,2±1,4**,*** |
| Количество не овулировавших фолликулов, (%) | 6,0±2,23* | 2,2±1,64* | 0,8±0,83 | 1,0±1,22* |
| левый яичник длина/ширина, мм | 19,8±1,3/4,4±0,89 | 20,8±0,83/5.8±0,83 | 22±0,7/6,0±1,0 | 10,4±1,14/4,6±0,54 |
| правый яичник длина/ширина, мм | 19,8±0,83/4,6±0,54 | 20,6±0,54/5,6±0,54 | 22,2±0,83/6,2±0,83 | 10,6±1,94/4,4±0,89 |
Примечание: *p<0,05;**p<0,01;***p<0,001
Самые низкие показатели индукции суперовуляции отмечались в группе I, донорам которой применяли стандартную методику введения препарата ФСГ-супер. При этом в среднем на самку пришлось 28,8±5,31 фолликулов, это значение имеет статистическую значимость (p<0,01) по сравнению с контрольной группой, а средние размеры яичников при этом составили: левый - 19,8±1,3 х 4,4±0,89 мм и правый - 19,8±0,83 х 4,6±0,54 мм. У самок-доноров из группы II, индукцию суперовуляции которым проводили по протоколу с однократной инъекцией препарата ФСГ-супер в сочетании с пролонгатором ПВС, показатели реакции были выше в сравнении с результатами в группе с классическим методом с использованием препарата ФСГ-супер, и характеризовались следующими значениями 33,2±4,32 фолликулов на самку в среднем, при этом также отмечалась статистически значимая разница (p<0,01) с показателями контрольной группы, а средние размеры яичников составили: левый - 20,8±0,83 х 5.8±0,83 мм и правый - 20,6±0,54 х 5,6±0,54 мм. В группе IV (контрольной), в которой не проводилась гонадотропная индукция суперовуляции, количество фолликулов и размеры яичников были в пределах референсных значений, характерных для осеменённых крольчих при стандартном физиологическом состоянии, и составили: 11,2±1,48 фолликулов на самку в среднем; при этом средние размеры яичников: были следующими левый - 10,4±1,14 х 4,6±0,54 мм и правый - 10,6±1,94 х 4,4±0,89 мм.
Показатели гонадотропного профиля крольчих при классическом протоколе введения препарата ФСГ-супер с целью индукции суперовуляции представлены в таблице 3.
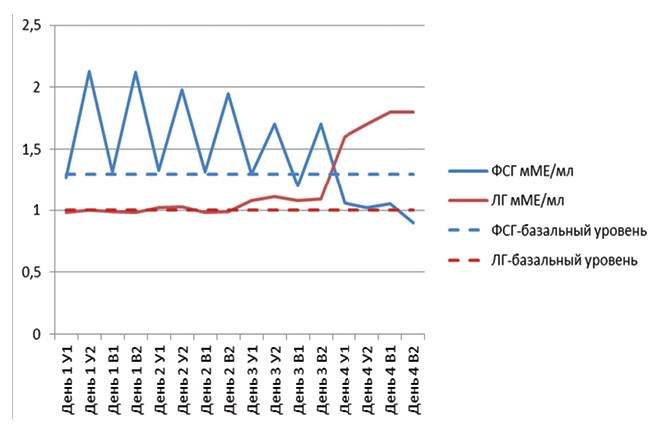
На рисунке 1 графически представлена динамика концентрации ФСГ и ЛГ в сыворотке крови в среднем по группе I. Из представленных данных видно, что уровень ФСГ у крольчих данной группы постоянно менялся, так через три часа после инъекции он достигал своих пиковых значений, но в то же время уже через 5-7 часов после инъекции концентрация ФСГ снижалась и возвращалась к базальному уровню. Уровень ЛГ, наоборот, на протяжении всего периода индукции супер-овуля ции практически не изменялся и находился на нижних значениях от 0,98±0,08 мМЕ/мл до 1,11±0,07 мМЕ/мл, и только после инъекции ХГЧ возрастал 1,8±0,07 мМЕ/мл, что приводило к овуляции созревших фолликулов.

Рис. 1. Динамика гонадотропных гормонов ФСГ и ЛГ в группе I
В группе II индукцию суперовуляции самкам проводили однократной инъекцией препарата ФСГ-супер в сочетании с пролонга-тором ПВС, показатели концентрации гонадотропных гормонов и их динамика в среднем по группе представлены в таблице 4 и на рисунке 2.
Таблица 3 Показатели концентрации гонадотропных гормонов в сыворотке крови крольчих при классическом способе введении препарата ФСГ-супер с целью индукции суперовуляции (группа I)
| Донор | 1 день | 2 день | 3 день | 4 день | |||||
|---|---|---|---|---|---|---|---|---|---|
| ФСГ мМе/мл | ЛГ мМе/мл | ФСГ мМе/мл | ЛГ мМе/мл | ФСГ мМе/мл | ЛГ мМе/мл | ФСГ мМе/мл | ЛГ мМе/мл | ||
| Донор 1 | у1 | 1,31 | 0,87 | 1.44 | 0,95 | 1,35 | 1,09 | 0,98 | 1,57 |
| у2 | 2,05 | 0,99 | 1,97 | 1,12 | 1,75 | 1,11 | 0,95 | 1,65 | |
| в1 | 1,37 | 0,91 | 1,37 | 0,97 | 1,28 | 0,99 | 1,03 | 1,74 | |
| в2 | 2,11 | 0,91 | 1,93 | 0,99 | 1,77 | 1,08 | 0,99 | 1,73 | |
| Донор 2 | у1 | 1,27 | 1,11 | 1,32 | 1,09 | 1,34 | 1,03 | 1,0 | 1,51 |
| у2 | 2,17 | 0,94 | 1,98 | 0,99 | 1,58 | 1,1 | 0,98 | 1,68 | |
| в1 | 1,28 | 0,97 | 1,29 | 0,99 | 1,3 | 1,0 | 1,1 | 1,78 | |
| в2 | 2,21 | 0,97 | 1,99 | 1,0 | 1,8 | 1,0 | 1,05 | 1,8 | |
| Донор 3 | у1 | 1,37 | 0,96 | 1,41 | 1,1 | 1,34 | 1,3 | 1,1 | 1,78 |
| у2 | 2,33 | 1,0 | 2,1 | 1,08 | 1,8 | 1,2 | 1,0 | 1,81 | |
| в1 | 1,4 | 1,0 | 1,35 | 1,0 | 1,38 | 1,3 | 0,97 | 1,92 | |
| в2 | 2,1 | 1,0 | 2,0 | 0,98 | 1,56 | 1,25 | 0,97 | 1,90 | |
| Донор 4 | у1 | 1,11 | 1,0 | 1,21 | 1,0 | 1,15 | 1,0 | 1,0 | 1,76 |
| у2 | 2,1 | 0,99 | 1,98 | 0,99 | 1,67 | 1,15 | 1,0 | 1,81 | |
| в1 | 1,17 | 0,99 | 1,25 | 0,99 | 1,11 | 1,15 | 1,0 | 1,85 | |
| в2 | 2,0 | 0,98 | 1,93 | 1,0 | 1,71 | 1,15 | 0,97 | 1,85 | |
| Донор 5 | у1 | 1,32 | 1,0 | 1,28 | 1,0 | 1,33 | 1,0 | 1,23 | 1,78 |
| у2 | 2,23 | 1,1 | 1,87 | 0,99 | 1,7 | 1,0 | 1,2 | 1,84 | |
| в1 | 1,4 | 1,1 | 1,37 | 0,98 | 1,3 | 1,0 | 1,15 | 1,87 | |
| в2 | 2,2 | 1,08 | 1,91 | 0,99 | 1,75 | 1,0 | 1,0 | 1,9 | |
| В среднем по группе | у1 | 1,27±0,09 | 0,98±0,08 | 1,33±0,09 | 1,02±0,06 | 1,3±0,08 | 1,08±0,12 | 1,06±0,1 | 1,6±0,1 |
| у2 | 2,13±0,06 | 1,0±0,05 | 1,98±0,08 | 1,03±0,06 | 1,7±0,08 | 1,11±0,07 | 1,02±0,09 | 1,7±0,08 | |
| в1 | 1,32±0,09 | 0,99±0,06 | 1,32±0,05 | 0,98±0,01 | 1,2±0,09 | 1,08±0,1 | 1,05±0,07 | 1,8±0,07 | |
| в2 | 2,12±0,08 | 0,98±0,06 | 1,95±0,44 | 0,99±0,008 | 1,7±0,09 | 1,09±0,1 | 0,9±0,03 | 1,8±0,07 | |
Примечание: У1 - утренняя концентрация гонадотропинов за 3 часа до введения препарата ФСГ-супер; У2 - утренняя концентрация гонадотропинов через 3 часа после введения препарата ФСГ-супер; В1 - вечерняя концентрация гонадотропинов за 3 часа до введения препарата ФСГ-супер; В2 - вечерняя концентрация гонадотропинов через 3 часа после введения препарата ФСГ-супер.
Таблица 4 Показатели концентрации гонадотропных гормонов в сыворотке крови крольчих при однократном введении препарата ФСГ-супер в сочетании с пролонгатором ПВС (группа II)
| Донор | 1 день | 2 день | 3 день | 4 день | |||||
|---|---|---|---|---|---|---|---|---|---|
| ФСГ мМе/мл | ЛГ мМе/мл | ФСГ мМе/мл | ЛГ мМе/мл | ФСГ мМе/мл | ЛГ мМе/мл | ФСГ мМе/мл | ЛГ мМе/мл | ||
| Донор 1 | У | 1,33 | 1,0 | 2,10 | 0,98 | 1,93 | 0,99 | 1,54 | 1,15 |
| В | 2,15 | 0,97 | 2,0 | 0,99 | 1,85 | 1,05 | 1,38 | 1,40 | |
| Донор 2 | У | 1,41 | 0,99 | 2,10 | 1,0 | 1,80 | 1,05 | 1,51 | 1,55 |
| В | 2,22 | 0,99 | 1,98 | 1,0 | 1,73 | 1,05 | 1,35 | 1,59 | |
| Донор 3 | У | 1,32 | 1,0 | 1, 98 | 0,99 | 1,81 | 1,0 | 1,48 | 1,25 |
| В | 1,98 | 1,0 | 1,95 | 1,0 | 1,72 | 0,99 | 1,32 | 1,43 | |
| Донор 4 | У | 1,27 | 1,0 | 2,05 | 1,0 | 1,93 | 0,98 | 1,45 | 1,34 |
| В | 2,0 | 1,0 | 2,0 | 1,0 | 1,85 | 1,0 | 1,34 | 1,40 | |
| Донор 5 | У | 1,35 | 0,98 | 2,0 | 0,99 | 1,87 | 1,0 | 1,53 | 1,24 |
| В | 2,15 | 0,98 | 1,95 | 1,0 | 1,75 | 1,05 | 1,37 | 1,54 | |
| В среднем по группе | У | 1,33±0,05 | 0,99±0,08 | 2,04±0,05 | 0,99±0,008 | 1,8±0,06 | 1,0±0,02 | 1,5±0,03 | 1,3±0,15 |
| В | 2,1±0,1 | 0,98±0,01 | 1,97±0,02 | 0,99±0,004 | 1,7±0,06 | 1,0±0,04 | 1,3±0,02 | 1,4±0,08 | |
Примечание: У - утренняя концентрация гонадотропинов; В - вечерняя концентрация гонадотропинов
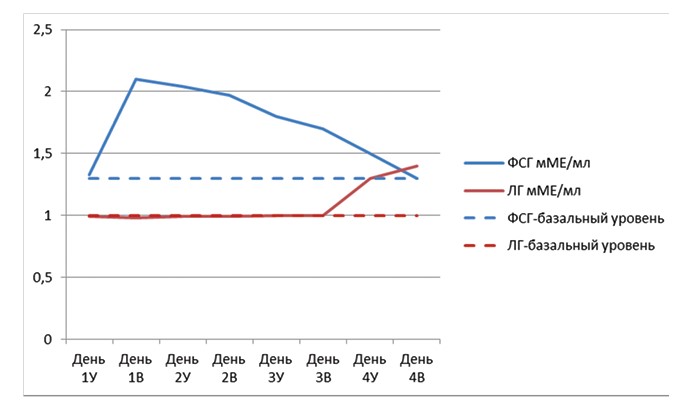
Рис. 2. Динамика гонадотропных гормонов ФСГ и ЛГ в группе II
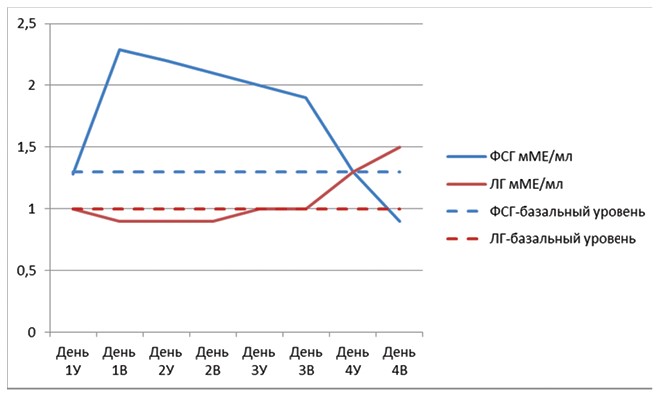
Рис. 3. Динамика гонадотропных гормонов ФСГ и ЛГ в группе III
По представленным данным видно, что утром в 1 день у самок данной группы концентрация ФСГ находилась на базальном уровне и составляла 1,33±0,05 мМе/мл в среднем по группе, однако к вечеру этого же дня в результате инъекции гонадотропного препарата этот показатель достиг своего пикового значения и составил 2,1±0,1 мМЕ/мл, при этом видно, что такой уровень концентрации оставался практически на протяжении суток и только на вторые сутки он заметно снизился. В то же время его концентрация на четвёртый день всё ещё оставалась на базальном уровне 1,3±0,02 мМЕ/мл. Концентрация ЛГ, как и в группе I, на протяжении всего периода индукции суперовуляции составляла 0,99±0,08 мМЕ/мл - 1,0±0,04 мМе/мл и только в день овуляции возрастала и достигала 1,4±0,08 мМе/мл, в среднем на самку-донора в группе.
При применении в качестве пролонгатора действия препарата ФСГ-супер ПЭГ гонадотропные профили крольчих имели следующие показатели и динамику, представленные в таблице 5 и на рисунке 3.
Таблица 5 Показатели концентрации гонадотропных гормонов в сыворотке крови крольчих при однократном введении препарата ФСГ-супер в сочетании с пролонгатором ПЭГ (группа III)
| Донор | 1 день | 2 день | 3 день | 4 день | |||||
|---|---|---|---|---|---|---|---|---|---|
| ФСГ | ЛГ | ФСГ | ЛГ | ФСГ | ЛГ | ФСГ | ЛГ | ||
| Донор 1 | У | 1,29 | 1,0 | 2,30 | 0,99 | 2,15 | 1,01 | 1,34 | 1,15 |
| В | 2,34 | 1,0 | 2,25 | 0,99 | 1,95 | 1,05 | 0,98 | 1,65 | |
| Донор 2 | У | 1,37 | 0,98 | 2,23 | 1,0 | 2,05 | 0,99 | 1,73 | 1,35 |
| В | 2,27 | 0,99 | 2,17 | 1,1 | 2,0 | 0,99 | 0,94 | 1,50 | |
| Донор 3 | У | 1,13 | 1,0 | 2,20 | 1,0 | 1,95 | 1,0 | 1,25 | 1,25 |
| В | 2,25 | 0,99 | 2,0 | 0,99 | 1,90 | 0,99 | 1,05 | 1,45 | |
| Донор 4 | У | 1,31 | 1,1 | 2,23 | 1,05 | 1,95 | 1,05 | 0,95 | 1,34 |
| В | 2,35 | 1,0 | 2,0 | 1,05 | 1,80 | 1,0 | 0,85 | 1,57 | |
| Донор 5 | У | 1,30 | 0,97 | 2,25 | 0,99 | 2,0 | 1,05 | 1,25 | 1,64 |
| В | 2,27 | 0,98 | 2,19 | 1,0 | 1,85 | 1,05 | 1,05 | 1,75 | |
| В среднем по группе | У | 1.28±0,08 | 1±0,05 | 2,2±0,04 | 0,9±0,06 | 2±0,09 | 1±0,02 | 1,3±0,2 | 1,3±0,1 |
| В | 2,29±0,04 | 0,9±0,08 | 2,1±0,1 | 0,9±0,08 | 1,9±0,07 | 1±0,03 | 0,9±0,08 | 1,5±0,1 | |
Так по полученным данным видно, что, как и в первых двух группах, изначально у всех самок концентрация ФСГ составляла 1,28±0,08 мМЕ/мл в среднем на самку в группе. В первые сутки после введения препарата ФСГ-супер концентрация ФСГ достигла своего пикового значения и составила 2,29±0,04 мМЕ/мл и оставалась практически неизменной в течение 2,5 суток. В то же время на 4 сутки концентрация составила 0,9±0,08 мМЕ/мл, что было ниже, чем в группе II на этот период 1,3±0,02 мМЕ/мл. Уровень ЛГ в группе III, также как и у самок предыдущих групп, оставался на протяжении трёх суток на базальном уровне и составлял 0,9±0,08 мМЕ/мл -1±0,03 мМЕ/мл в среднем по группе. При этом показано, что на 4 сутки фиксировался его рост, и к окончанию концентрация ЛГ в группе III составила 1,5±0,1 мМЕ/мл.
В контрольной группе показатели концентрации гонадотропинов ФСГ и ЛГ и их динамика на протяжении всего периода исследования находились в пределах референсных значений, представленных в таблице 6 и на рисунке 4.
Таблица 6 Показатели концентрации гонадотропных гормонов в сыворотке крови крольчих контрольной группы
| Донор | 1 день | 2 день | 3 день | 4 день | |||||
|---|---|---|---|---|---|---|---|---|---|
| ФСГ мМе/ мл | ЛГ | ФСГ | ЛГ | ФСГ | ЛГ | ФСГ | ЛГ | ||
| Донор 1 | У | 1,29 | 0,99 | 1,30 | 0,99 | 1,35 | 0,99 | 1,0 | 1,05 |
| В | 1,34 | 1,0 | 1,33 | 0,99 | 1,37 | 0,98 | 0,99 | 1,55 | |
| Донор 2 | У | 1,33 | 1,0 | 1,23 | 0,98 | 1.30 | 1,05 | 1,15 | 1,05 |
| В | 1,33 | 0,99 | 1,27 | 0,98 | 1,28 | 1,0 | 1,0 | 1,27 | |
| Донор 3 | У | 1,13 | 0,98 | 1,2 | 1,0 | 1,23 | 1,0 | 1,05 | 1,0 |
| В | 1,15 | 0,99 | 1,18 | 0,99 | 1,24 | 1,0 | 0,99 | 1,55 | |
| Донор 4 | У | 1,31 | 1,1 | 1,23 | 1,05 | 1,25 | 1,05 | 1,05 | 1,24 |
| В | 1,35 | 1,0 | 1,25 | 0,99 | 1,25 | 1,1 | 1,0 | 1,48 | |
| Донор 5 | У | 1,30 | 1,0 | 1,25 | 0,99 | 1,3 | 1,05 | 1,05 | 1,05 |
| В | 1,30 | 1,0 | 1,27 | 1,05 | 1,3 | 1,05 | 1,05 | 1,45 | |
| В среднем по группе | У | 1,2±0,08 | 0,9±0,07 | 1,2±0,07 | 0,9±0,06 | 1,2±0,03 | 1±0,04 | 1,06±0,05 | 1±0,09 |
| В | 1,2±0,08 | 0,9±0,04 | 1,3±0,04 | 0,9±0,06 | 1,2±0,02 | 1±0,04 | 1±0,02 | 1,46±0,11 | |
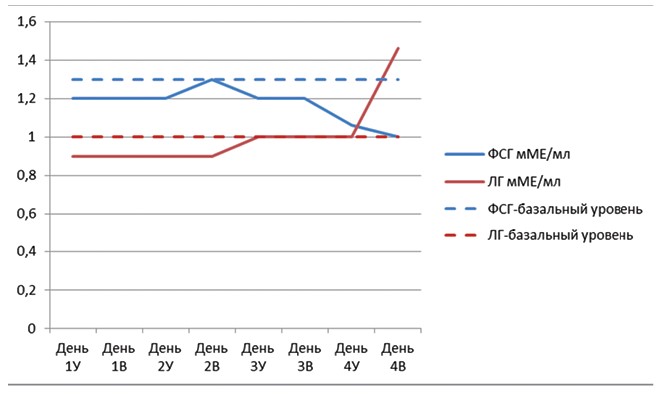
Рис. 4. Динамика гонадотропных гормонов ФСГ и ЛГ в группе IV (контроль)
Так, уровень содержания ФСГ отмечался в следующих значениях: 1 день - 1,2±0,08 мМЕ/мл и в 4 день в период овуляции достиг своей низшей концентрации 1,0±0,02 мМЕ/мл на самку в среднем по группе. Концентрация ЛГ также находилась в значениях, соответствующих физиологическому уровню 0,9±0,04 мМЕ/мл - 1±0,04 мМЕ/мл, и возрастала после инъекции ХГЧ в период овуляции 1,46±0,11 мМЕ/мл.
Заключение. По результатам проведённого исследования можно сделать вывод, что при применении препаратов, содержащих гипофизарные гонадотропины в сочетании с пролонгаторами с целью индукции суперовуляции у крольчих, установлено статистически значимое повышение количества созревших фолликулов в сравнении с классическим протоколом индукции суперовуляции гипофизарными гонадотропинами, также при применении ПЭГ в качестве пролонгато-ра действия препаратов, содержащих гипофизарные гонадотропины, прослеживалась тенденция повышения созревших и овулировавших фолликулов у крольчих по сравнению с пролонгатором ПВС. При этом было установлено что, концентрация ФСГ в сыворотке крови крольчих-доноров при индукции суперовуляции в группах, где применяли пролонгаторы действия препаратов, содержащих гипофизарные гонадотропины, достигала своего пика в первые сутки ИС и оставалась практически неизменной в течение 2-2,5 суток. Концентрация ЛГ во всех группах в течение всего периода ИС оставалась на базальном уровне и возрастала только в период овуляции созревших фолликулов, после инъекции ЧХГ, при этом у крольчих, где применяли в качестве пролонгатора ПЭГ, концентрация ЛГ была выше, чем у крольчих группы, в которой применяли ПВС. Таким образом, проведённое исследование показывает, что применение препаратов, содержащих гипофизарные гонадотропины, с целью индукции суперовуляции в сочетании с пролонгаторами их действия позволяет сократить количество инъекций до одной и при этом повысить эффективность процедуры.
Список литературы
Резюме. В современном животноводстве индукцию суперовуляции в основном проводят для получения эмбрионов крупного рогатого скота, в то же время этот подход используется для отработки, совершенствования и изучения физиологических процессов, происходящих при гормональной индукции фол-ликулогенеза, и может проводиться на модельных животных. Для индукции суперовуляции в основном применяют препараты, содержащие гонадотропины гипофизарного происхождения. Известно, что такие препараты обладают рядом преимуществ по сравнению с сывороточными гонадотропинами, но в то же время у них очень короткий период катаболизма, что вызывает ряд трудностей при проведении процедуры индукции суперовуляции. В этой связи изучение и отработка надёжных методов индукции суперовуляции у самок млекопитающих обладает практической и исследовательской значимостью. В работе представлены данные по изучению гонадотропных профилей крови крольчих-доноров эмбрионов при различных способах индукции суперовуляции гипофизарными гонадотропинами. Приведены качественные и количественные показатели индукции суперовуляции: общая реакция яичников, количество жёлтых тел, количество неовулировавших фолликулов, размеры яичников. Показана динамика концентрации фолликулостимулирующего гормона (ФСГ) и лютеинизирующего гормона (ЛГ), в зависимости от способа введения препаратов, содержащих гонадотропины гипофизарного происхождения. Полученные данные показывают, что при применении пролонгаторов были достигнуты наилучшие показатели.
Так, при индукции суперовуляции у крольчих препаратом ФСГ-супер в сочетании с поливиниловым спиртом (ПВС) и полиэтиленгликолем (ПЭГ) были получены статистически значимые отличия в количестве созревших и овулировавших фолликулов относительно контрольной группы и группы, где применяли классический протокол введения препарата ФСГ-супер с целью индукции суперовуляции. Между группами, где применяли гонадотропины в сочетании с пролонгаторами, статистически значимых отличий установлено не было, при этом прослеживалась тенденция увеличения значений показателей индукции суперовуляции в группе с пролонгатором ПЭГ относительно группы с пролонгатором ПВС.
Ключевые слова: кролики, самки-доноры, гонадотропные гормоны, про-лонгаторы, фолликулостимулирующий гормон, лютеинизирующий гормон, суперовуляция, фолликулы, жёлтое тело.
Сведения об авторах:
Косовский Глеб Юрьевич, доктор биологических наук, профессор, главный научный сотрудник, директор ФГБНУ «Научно-исследовательский институт пушного звероводства и кролиководства имени В.А. Афанасьева»; 140143, Московская обл., Раменский район, пос. Родники, ул. Трудовая, 6; тел.: 8-495-7442642; e-mail: niipzk@mail.ru.
Ответственный за переписку с редакцией: Попов Дмитрий Владимирович, кандидат биологических наук, ведущий научный сотрудник, заведующий отделом биотехнологии ФГБНУ «Научно-исследовательский институт пушного звероводства и кролиководства имени В.А. Афанасьева»; 140143, Московская обл., Раменский район, пос. Родники, ул. Трудовая, 6; тел.: 8-967-1469029; e-mail: popov.bio@gmail.com.
http://vetkuban.com/num2_202110.html