УДК:619:579.841.11[615.33]:[636.4]
Скориков А.В.,Басова Н.Ю. Краснодарский НИВИ-обособленное структурное подразделение
ФГБНУ «Краснодарский научный центр по зоотехнии и ветеринарии», г. Краснодар
Кривонос Р.А. государственное управление ветеринарии Краснодарского края, г. Краснодар
Черных О.Ю. ГБУ КК «Кропоткинская краевая ветеринарная лаборатория», г. Кропоткин
Введение. Одной из актуальных проблем свиноводства продолжают оставаться заболевания поросят и молодняка свиней, обусловленные условно патогенной микрофлорой, среди которых одно из ведущих мест занимает синегнойная инфекция [5]. Pseudomonas aeruginosa вызывает заболевания с тяжелым клиническим течением и значительным уровнем летальности среди поросят, а также проявлением послеродовых эндометритов у свиноматок [10]. Широкое использование антибиотиков в свиноводческих хозяйствах приводит к формированию патогенных резистентных штаммов синегнойной палочки [11]. Проблема формирования резистентных штаммов Pseudomonas aeruginosa к антибиотикам в значительной мере характерна не только для ветеринарии, но и медицины [4, 7, 13, 16]. Pseudomonas aeruginosa обладает резистентностью к значительному количеству антимикробных препаратов [2, 8, 12]. Высокая устойчивость псевдомонад к антибактериальным препаратам, в том числе к антибиотикам в значительной мере обусловлена: генетической устойчивостью, заложенной в плазмидах резистентности (R-плазмидах), а не хромосомами бактериальной клетки [17], способностью отдельных штаммов продуцировать р-лактамазы [15], что приводит к формированию резистентных штаммов синегнойной палочки к р-лактамным антибиотикам, повышенным количеством мутаций в биоплёнке бактерий. Ряд исследователей отмечают резистентность культур Р. aeruginosa к эритромицину, пенициллину, мономицину, ле-вомицетину ампициллину [1, 3].
Исследователи, изучая чувствительность к антибиотикам штаммов P.aeruginosa, выделенных из спермы и смывов препуция быков и хряков-производителей, отмечали высокую бактерицидную активность полимиксина М и гентамицина [9]. Чувствительность к антибиотикам изолятов Pseudomonas аeruginosa, выделенных из патологического материала от поросят и смывов из половых органов свиноматок, составила 60,7% [6]. При использовании антибиотиков в свиноводстве для лечения больных животных необходимо учитывать биологические свойства Pseudomonas aeruginosa формировать устойчивость к антибиотикам.
Цель исследований - изучение чувствительности к антибиотикам штаммов Pseudomonas aeruginosa, выделенных из диагностического и патологического материала в свиноводческих хозяйствах.
Материалы и методы исследований. Исследования проводили на базе ГБУ КК «Кропоткинская краевая ветеринарная лаборатория» и лаборатории терапии ФГБНУ Краснодарский НИВИ на диагностическом и патологическом материале (пробы внутренних паренхиматозных органов павших поросят: селезенки, печени, почек; лимфатических узлов, головного мозга), отобранном в свиноводческих хозяйствах Курганинского, Гулькевического, Брюховецкого. Ейского, Динского и Усть-Лабинского районов Краснодарского края. Исследованию было подвергнуто около 40 штаммов Pseudomonas aeruginosa, идентифицированных на основании морфологических, тинкториальных и культурально-биохимических свойств. На элективных питательных средах изучали характер роста и морфологию колоний, для выявления гемолитической и лецитиназной активности, посевы культивировали на 5%-м кровяном агаре и агаре с использованием желчи. Протеолитическую активность по стандартным методикам, пигментообразование выявляли путем посевов культур на мясопептонный агар с содержанием 1% глицерина и глюкозы, биохимические свойства выделенных культур определяли с помощью тест-систем NEFERMtest фирмы (ЭРБА ЛАХЕМА, Чехия). Для определения чувствительности выделенных штаммов Pseudomonas aeruginosa к антибиотикам использовали диско-диффузионный метод, основанный на задержке зоны роста данного возбудителя на плотной питательной среде, с оценкой её диаметра. Для приготовлении суспензии использовали стерильный физиологический раствор хлористого натрия и 18-ти часовые культуры Pseudomonas aeruginosa, которые культивировали на МПА. Суспензию наносили пипеткой на поверхность чашки Петри с МПА в объеме 1-2 мл, равномерно распределяя по поверхности, удаляя избыток суспензии пастеровской пипеткой. Приоткрытые чашки Петри подсушивали в боксах при комнатной температуре в течение 10-ти минут. Аппликацию дисков проводили с помощью стерильных пинцетов, после чего чашки Петри помещали в термостат кверху дном и подвергали культивированию при 37°С в течение 24 ч. Измерение диаметра зон задержки роста бактерий производили с точностью до 1,0 мм [14]. Для статистической обработки использовали методы вариационной статистики.
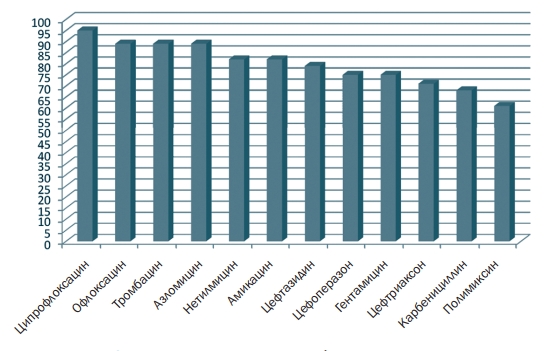
Результаты исследований и их обсуждение. Выделенные культуры штаммов синегнойной палочки характеризовались культурально-морфологическими свойствами: отрицательной окраской по Граму, располагались в виде палочек, на мясопептонном агаре образовывали крупные плоские колонии R-формы, на мясопептонном агаре с глицерином штаммы образовывали мелкие 1-2 мм и средние 2-4 мм плоские и выпуклые колонии R- и S-форм с окрашиванием среды в сине-зеленый и бледно-зеленый цвета, на 5%-м кровяном агаре все штаммы вызывали зону B-гемолиза. При изучении биохимических свойств выделенные штаммы проявили значительную вариабельность, однако практически 90% штаммов не образовывали индол, не редуцировали нитраты, положительно реагировали на оксидазу, и цитрат Симонса, не разлагали глюкозу, сахарозу, лактозу, мальтозу. При изучении чувствительности штаммов Pseudomonas aeruginosa к антибиотикам было установлено, что из изучаемых антибиотиков ципрофлаксацин наиболее эффективно подавлял рост всех выделенных штаммов 95% (рисунок 1), 80% штаммов были чувствительны к офлаксацину, тобрамицину, азломицину, нетилмицину, амикацину; 79%-цефтазидину, 75%-цефоперазону, 75%-гентамицину, 71%-цефтри-аксону, 68%-карбенициллину, 61%-полимиксину.

Рис. 1. Чувствительность к антибиотикам штаммов Pseudomonas aeruginosa (%)
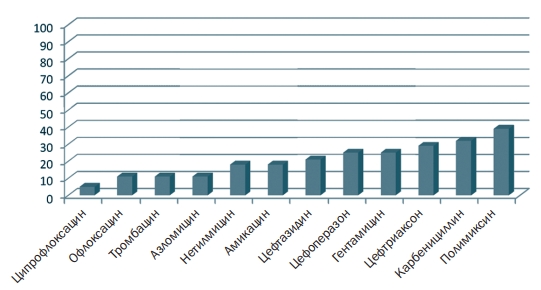
Рис. 2. Встречаемость резистентных к антибиотикам штаммов Pseudomonas aeruginosa (%)
Штаммы Pseudomonas aeruginosa проявляли резистентность к полимиксину-39%, карбенициллину-32%, цефтриаксону-29%, гента-мицину-25%, цефоперазону-25%, цефтазидину-21% (рисунок 2).
Проведенные исследования позволили установить, что изучаемые штаммы синегнойной палочки, проявляли довольно высокую (от 32 до 39%) резистентность к антибиотикам группы циклических полипептидов полимиксину и группы пенициллинов карбенициллину, несколько пониженную резистентность (25%), штаммы проявляли в отношении антибиотиков из группы аминогликозидов гентамицин и цефалоспоринов третьего поколения -цефаперазон и бетталактам-ных цефалоспоринов - цефтриаксон. В то же время низкая резистентность изучаемых штаммов Pseudomonas aeruginosa была выявлена к антибиотикам из группы полусинтетических пенициллинов - азлоцил-лин и фторхинолон. Наименьшая устойчивость изучаемых штаммов синегнойной палочки к ципрофлоксацину (5%), на наш взгляд, объясняется максимальной активностью данного препарата в отношении данного вида микроорганизмов, а также незначительным использованием данного препарата в свиноводческих хозяйствах при лечении псевдомоноза. Для выявления взаимосвязи изучаемых штаммов синегнойной палочки, продуцирующих факторы патогенности, в том числе различные пигменты, и антибиотикорезистентностью необходимо проведение дополнительных исследований.
Заключение. В результате проведенных исследований установлен уровень резистентности к антибиотикам штаммов Pseudomonas aeruginosa, циркулирующих в свиноводческих хозяйствах Краснодарского края. Наиболее эффективными лекарственными средствами в отношении синегнойной палочки были фторхинолоны, полусинтетические пенициллины, менее эффективными - аминогликозиды и цефалоспорины. Неэффективными - циклические полипептиды и пенициллины. Использование антибиотиков для проведения антибактериальной терапии в свиноводческих предприятиях при данной инфекции необходимо проводить с учетом определения чувствительности к ним штаммов Pseudomonas aeruginosa в ветеринарных лабораториях края.
Список литературы:
Резюме. В ветеринарной медицине исследования по определению чувствительности микроорганизмов, в том числе различных штаммов синегнойной палочки к антибиотикам являются одними из приоритетных направлений, так как, позволяют разработать наиболее эффективные схемы профилактики и лечения псевдомоноза различных половозрастных групп свиней. Однако, использование различных антибактериальных средств и в первую очередь антибиотиков в свиноводстве, без предварительного проведения исследований по определению чувствительности штаммов синегнойной палочки к антибиотикам является одной из основных причин циркуляции резистентных штаммов Pseudomonas aeruginosa в свиноводческих хозяйствах края. В статье приведены результаты исследований по выявлению резистентности штаммов Pseudomonas aeruginosa, выделенных от животных в свиноводческих хозяйствах к антибиотикам. При проведении исследований использовали антибиотики различных групп, обладающих как бактерицидными, так и бактериостатическими свойствами. В ходе проведенных исследований было установлено, что наиболее эффективными антибиотиками в отношении выделенных штаммов синегнойной палочки были фторхинолоны, полусинтетические пенициллины, а также аминогликозиды и антибиотики цефалоспоринового ряда. Полученные результаты исследований позволяют рассматривать данные группы антибиотиков, как одни из перспективных при данной инфекции в свиноводстве.
Ключевые слова: штаммы Pseudomonas aeruginosa, поросята, свиноматки, антибиотики, фторхинолоны, циклические полипептиды, пенициллины, аминогликозиды, цефалоспорины, питательные среды, культурально-морфологические и биохимические свойства, диско-диффузионный метод, антибиотикорезистентность, свиноводческие хозяйства.
Сведения об авторах:
Басова Наталья Юрьевна, доктор ветеринарных наук, заведующая отделом терапии и акушерства Краснодарского НИВИ - обособленного структурного подразделения ФГБНУ «Краснодарский научный центр по зоотехнии и ветеринарии»; 350004, г. Краснодар, ул. 1-я линия, 1; тел.: 8-861-2216220; e-mail: knivi@list.ru.
Кривонос Роман Анатольевич, руководитель государственного управления ветеринарии Краснодарского края; 350000, г. Краснодар, ул. Рашпилевс-кая, 36; тел.: 8-861-2621923; e-mail: sinkubani@mail.ru.
Черных Олег Юрьевич, директор ГБУ КК «Кропоткинская краевая ветеринарная лаборатория», доктор ветеринарных наук; 352380, Краснодарский край, г. Кропоткин, ул. Красноармейская, д. 303, тел.: 8-86138-62314; e-mail: gukkvl50@kubanvet.ru.
Ответственный за переписку с редакцией: Скориков Александр Владимирович, кандидат биологических наук, заместитель директора по научной работе Краснодарского НИВИ - обособленного структурного подразделения ФГБНУ «Краснодарский научный центр по зоотехнии и ветеринарии»; 350004, г. Краснодар, ул. 1-я линия, 1; тел.:8- 861- 2216220; e-mail: knivi@list.ru.
http://vetkuban.com/num2_201802.html