УДК 619: 615.371:579.831:001.891.53
DOI 10.33861/2071-8020-2025-1-4-7
Оригинальное эмпирическое исследование
Безбородова Н. А., Порываева А. П., Шилова Е. Н., Кожуховская В. В., Соколова О. В. Федеральное
государственное бюджетное научное учреждение «Уральский федеральный аграрный научно-исследовательский центр
Уральского отделения Российской академии наук», г. Екатеринбург
Яцентюк С. П. Федеральное государственное бюджетное учреждение «Всероссийский государственный
Центр качества и стандартизации лекарственных средств для животных и кормов», г. Москва
Аннотация. На животноводческих предприятиях в борьбе против инфекционных заболеваний особое значение имеют рациональные схемы использования вакцин в сочетании с зоогигиеническими и ветеринарно-санитарными мероприятиями. В настоящее время в реестр зарегистрированных лекарственных средств для ветеринарного применения Российской Федерации включено 15 вакцин против клостридиозов крупного рогатого скота российских и зарубежных производителей. Отечественными исследователями выявлено видовое разнообразие видов Clostridium в 16 субъектах Российской Федерации (Московской, Тюменской, Рязанской, Курской, Иркутской, Нижегородской, Кировской, Тверской, Белгородской, Псковской, Саратовской, Самарской, Челябинской областях, в республике Мордовия и т.д.) с преобладанием Cl. perfringens, Cl. septicum, Cl. sporogenes, единично - Cl. difficile, Cl. butyricum, Cl. bifermentans. По данным Департамента ветеринарии в Свердловской области количество вакцинированного против эмфизематозного карбункула поголовья крупного рогатого скота в 2015 году составляло менее 10% от общего количества, в 2022 году число вакцинированных животных увеличилось до 73%, что снизило выявление данного патогена в 3 раза. В 2020-2022 гг. в биопробах от крупного рогатого скота Свердловской области молекулярно-генетическими методами были выявлены геномы ДНК Cl. difficile и Cl. perfringens в 76,2% случаев. В 2023 году случаи обнаружения геномов Cl. difficile и Cl. perfringens составляли 54,7% от исследованных образцов, что на 21,5% меньше, чем в предыдущий период. Типирование Cl. difficile показало, что токсикогенностью обладали 41,3% изолятов. В 17,2% случаев Cl. difficile были нетоксигенные. При типировании Cl.perfringens установлено, что токсинотип А являлся доминирующим (56,3%), единично выявлены токсинотипы D и Е. Выявление доминирующих видов возбудителей и их токсинотипов позволило оценить эффективность используемых вакцин. Большая часть сельскохозяйственные предприятий использовали вакцину, изготовленную из B- и Е-токсоидов Clostridium perfringens типов В, С и D. Реже применяли вакцины, в составе которых есть анатоксин Cl. perfringens типа А. При этом клостридии этого типа в наших исследованиях были доминирующими (56,3%), а Cl. perfringens типов D и Е - единичными. Среди исследуемых сельскохозяйственных предприятий встречались такие, где не осуществлялась вакцинопрофилактика клостридиальных инфекций, но после проведения лабораторных исследований ими были введены в ежегодную схему вакцины против клостридиозов крупного рогатого скота.
Ключевые слова: иммунизация, вакцина, специфическая профилактика, клостридии, анаэробы, крупный рогатый скот, Clostridium.
Клостридиозы - это заболевания у теплокровных животных, вызываемые анаэробными спорообразующими микроорганизмами из рода Clostridium, который включает 250 видов бактерий [1, 3]. Отдельные виды, сами по себе, не способны вызывать болезни, но в сочетании с другими анаэробными бактериями могут усложнять инфекцию [4, 6]. К патогенным видам относятся Cl. botulinum, Cl. perfringens, Cl. chauvoei, Cl. septicum, Cl. haemolyticum, Cl. sordelli, Cl. sporogenes, Cl. tetani, Cl. histolyticum, Cl. novyi [2, 9].
Клостридиальные инфекции приводят к экономическим потерям на фермах из-за вынужденного убоя и затрат на лечение животных [5, 7]. Патогенность клостридий обусловлена вырабатываемыми ими экзотоксинами и ферментами агрессии. Разные виды клостридий производят различные экзотоксины с гемолитическим, некротизирующим и летальным действиями [3, 7, 20]. Экзотоксины клостридий вызывают повреждения желудочно-кишечного тракта, мягких тканей и нервной системы. Для крупного рогатого скота особое значения имеют такие клостридиальные инфекции, как эмфизематозный карбункул, анаэробная энтеротоксемия, злокачественный отек, столбняк, геморрагический энтерит, некротический гепатит и энтерит [10, 15, 19].
Клинико-лабораторная ветеринарная диагностика играет важную роль в реализации программ по оздоровлению, профилактике и ликвидации заболеваний сельскохозяйственных животных, обусловленных бактериями рода Clostridium. Каждый год арсенал диагностических методов пополняется новыми технологиями, позволяющими не только выявлять патогенные штаммы возбудителей, но и прогнозировать риски распространения высокопатогенных штаммов вирусов и микроорганизмов, а также возможность межвидовой передачи возбудителей [3, 11, 14]. Особое значение для улучшения методологии диагностических исследований имеет биоинформационная база данных о молекулярно-генетических характеристиках возбудителей вирусных и бактериальных инфекций, доминирующих на территории Российской Федерации, и ее постоянное обновление. На данный момент в реестр зарегистрированных лекарственных средств РФ включено более 15 вакцин и анатоксинов против клостри-диозов крупного рогатого скота российских и зарубежных производителей [2, 5, 7]. В настоящее время отечественными исследователями выявлено видовое разнообразие Clostridium в 16 регионах Российской Федерации (Московской, Тюменской, Рязанской, Курской, Иркутской, Нижегородской, Кировской, Тверской, Белгородской, Псковской, Саратовской, Самарской, Челябинской областях, в республике Мордовия и т.д.) с доминированием изолятов Cl. perfringens, Cl. septicum, Cl. sporogenes, единично - Cl. difficile, Cl. butyricum, Cl. bifermentans [5, 6, 7, 8]. Однако, согласно мнению как отечественных, так и иностранных специалистов, необходимо расширять базу данных молекулярно-генетических характеристик патогенных бактерий рода Clostridium [12, 13, 17]. Это позволит создавать более эффективные иммунобиологические препараты, разрабатывать новые лекарственные средства и средства дезинфекции. Анализ научных публикаций показывает, что обогащение биоинформа-ционной базы данных о молекулярно-генетических свойствах возбудителей инфекций на конкретной территории при определенных природно-географических и социально-экономических условиях поможет не только определить патогенные свойства возбудителей и эпизоотические особенности географического распространения генетических вариаций, но и улучшить программы оздоровления и защиты сельскохозяйственных животных от инфекционных заболеваний, а также точнее прогнозировать эпизоотические риски [2, 3, 14, 18, 20].
Цель исследования - провести оценку эффективности вакцин от клостридиозов крупного рогатого скота с учётом молекулярно-генетических характеристик анаэробных возбудителей, доминирующих на территории Уральского региона.
Материалы и методы исследований. Исследования проведены в отделе геномных исследований и селекции животных, в лаборатории вирусных инфекций на базе Уральского НИВИ -структурном подразделении ФГБНУ УрФАНИЦ УрО РАН.
Работа проведена в рамках государственного задания Министерства науки и высшего образования Российской Федерации № 0532-2021-0007 «Изучение структуры антигенного пейзажа возбудителей эмерджентных инфекций сельскохозяйственных животных, биологических особенностей механизмов их взаимодействия с макроорганизмом».
Клинические исследования крупного рогатого скота молочных пород проведены в 30 сельскохозяйственных организациях (СХО) Свердловской области.
Объектом исследования стал крупный рогатый скот: телята, телки, нетели, стельные коровы, дойные коровы. Предмет исследования - биоматериал.
ДНК анаэробов выделяли с помощью наборов «Diatom DNA Prep 200» (компания ООО «ИзоГен», Москва), ПЦР-диа-гностику проводили с применением тест-систем «РеалБест-Вет ДНК Clostridium difficile/ Clostridium perfringens». Типизацию клостридий проводили с использованием набора реагентов «РеалБест-Вет ДНК Clostridium difficile tcdA/tcdB/CDT» (АО «Вектор-Бест», Москва). Токсинотипы Cl. perfringens определяли методом ПЦР на основании наличия генов etx, iap, plc, cpe и cpb. Амплификацию в режиме реального времени осуществляли с применением оборудования Rotor-Gene 3000 (Corbett Life Science, Австралия), QuantStudio 5 (США), термоциклера Applied Biosystems 2720 (Сингапур). Генотипирование проводили по протоколу, предложенному Julian I. Rood (Rood J.I., 2018). Исследования выполнены с применением детекции в агарозном геле с использованием мини-камеры Mini-Sub Cell GT (Bio-Rad, США), камеры CHEMIDOCXRS+ и системы гель-документации GelDoc XR+ (Bio-Rad, США).
В качестве контроля использовали ДНК, выделенную из чистых культур: Cl. perfringens ATCC 13124 тип A (BD Microtrol, США), Cl. perfringens № 307 тип А, Cl. perfringens «LD4» тип В, Cl. perfringens «Октябрь» тип С, Cl. perfringens «Амо» тип С, Cl. perfringens № 213 тип D, Cl. perfringens № 413 тип Е, Cl. perfringens №342 тип Е (коллекция штаммов ФГБУ «ВГНКИ», Москва).
Для обработки полученных данных использовали программу Microsoft Excel, входящую в пакет программ Microsoft Office Pro 19.
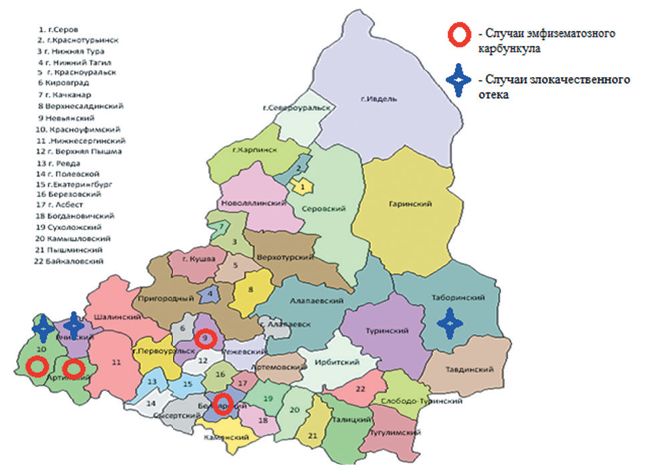
Результаты исследований и их обсуждение. По данным Департамента ветеринарии Свердловской области при проведении эпизоотологического мониторинга за период 2007-2023 гг. было зарегистрированы случаи эмфизематозного карбункула в 5 сельхозпредприятиях, расположенных на территории Красноуфимского, Белоярского, Артинского и Невьянского районов. Также в этот период зарегистрировано случаи злокачественного отека в 4 сельхозпредприятиях Новоуральского городского округа, Табо-ринского, Красноуфимского и Ачитского районов (рисунок 1).

Рис. 1. Субъекты Свердловской области, на территории которых зарегистрированы заболевания крупного рогатого скота, вызываемые бактериями рода Clostridium (по данным Департамента ветеринарии Свердловской области за 2007-2023 гг.)
Из числа противоклостридиозных вакцин для профилактики болезней крупного рогатого скота, внесенных в государственный реестр лекарственных средств для ветеринарного применения, на молочно-товарных фермах Свердловской области применяется шесть. По данным Департамента ветеринарии, в Свердловской области количество вакцинированного поголовья против эмфизематозного карбункула (ЭМКАР) крупного рогатого скота в 2015 году составляло менее 10% от общего количества крупного рогатого скота в области. В 2022 году их доля увеличилась до 73%, что снизило выявление эмфизематозного карбункула у крупного рогатого скота в 3 раза.
Однако, несмотря на широкое применение специфических иммунобиологических препаратов, разнообразных антибиотиков и средств дезинфекции проблема клостридиозов продолжает оставаться одной из острейших в животноводческой отрасли.
Ранее проведенные исследования (2020-2022 гг.) показали, что в животноводческих предприятиях, расположенных на территории Свердловской области, в биопробах от крупного рогатого скота молекулярно-генетическими методами определялись ДНК Cl. difficile и Cl. perfringens в 76,2% случаев (рисунок 2). В 2023 году суммарная доля обнаружения геномов Cl. difficile и Cl. perfringens в биопробах от крупного рогатого скота составила 54,7%, что на 21,5% меньше, чем в предыдущий период (рисунок 3). Отмечали увеличение суммарной доли выявления Cl. difficile в пробах - до 58,5% (в период исследований 2020-2022 гг - 56,2%). Суммарная доля обнаружения генома Cl. perfringens в пробах составила 41,5%. Необходимо отметить, что, как и в период исследований 2020-2022 гг., в 25% случаев геномы Cl. diffcile и Cl. perfringens в биоматериалах обнаруживали совместно (рисунок 4).
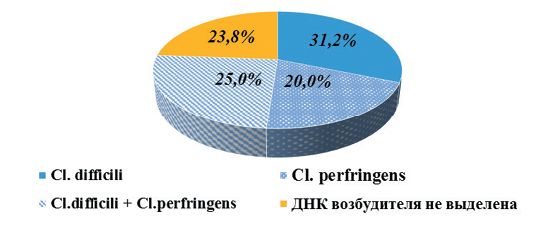
Рис. 2. Диагностика и идентификация молекулярно-генетическими методами патогенов рода Clostridium в биопробах от крупного рогатого скота на территории Свердловской области в 2020-2022 гг.
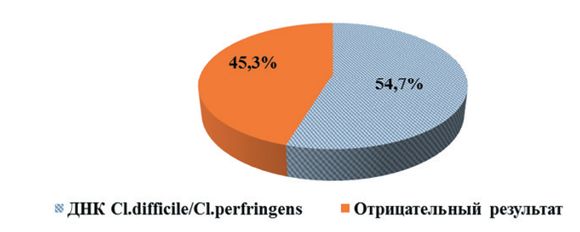
Рис. 3. Диагностика молекулярно-генетическими методами патогенов рода Clostridium в биопробах от крупного рогатого скота на территории Свердловской области в 2023 г.
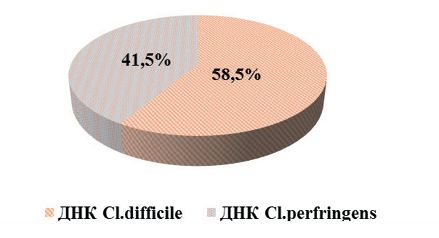
Рис. 4. Идентификация молекулярно-генетическими методами патогенов рода Clostridium в биопробах от крупного рогатого скота на территории Свердловской области в 2023 г.
При выявлении генов tcdA, tcdB Cl. diffcile, детерминирующих наличие токсинов, было установлено, что токсикогенностью обладали 41,3% возбудителей. В 17,2% случаев у бактерий Cl. diffcile было показано отсутствие полного патогенного локуса - «нетокси-генные Cl. diffcile». При типировании Cl. perfringens установлено, что токсинотип А являлся доминирующим и составлял 56,3 % от всех выявленных клостридий этого вида. Также были выявлены единичные случаи токсинотипов D и Е возбудителя.
Выявление доминирующих видов возбудителей и их токсино-типов позволило оценить эффективность используемых вакцин. Около 70% сельскохозяйственных предприятий использовали вакцину, содержащую B- и Е-токсоиды Cl. perfringens типов В, С и D, а-токсоиды Cl. novyi тип В, а-токсоиды Cl. septicum, ана-культуры Cl. chauvoei, токсоиды Cl. tetani. Также в отдельных хозяйствах (20%) применялась вакцина, в состав которых входили одно из проявлений патогенного синергизма бактерий Clostridium. Бактерия Cl. difficile обладает патогенным потенциалом, но её штаммы не являются антигенным компонентом противоклостри-диозных вакцин. Как известно, при реализации патогенного потенциала микроорганизма антигенная нагрузка на иммунную систему животного - «хозяина» возрастает, и иммунный ответ на введение вакцины может либо вообще отсутствовать, либо быть «неполноценным». Полученные результаты представляют научный интерес в области изучения патогенного синергизма микроорганизмов и требуют дополнительных исследований.
Выполненная нами работа по оценке эффективности вакцин для профилактики и оздоровления популяций крупного рогатого от заболеваний, обусловленных бактерий рода Clostridium, с учётом молекулярно-генетических характеристик доминирующих в регионе видов возбудителей клостридиоза относится к области научно-прикладных исследований. Полученные результаты дополняют и детализируют базу данных о молекулярно-генетической структуре токсинотипов бактерий рода Clostridium. Результаты исследования могут быть использованы для усовершенствования алгоритмов лабораторной диагностики и при разработке новейших средств специфической профилактики и лечения клостридио-зов крупного рогатого скота.
Полученные данные по молекулярно-генетическим свойствам возбудителей инфекционных заболеваний животных имеют значение для отрасли сельскохозяйственной промышленности, биологии и медицины, так как позволят определять риски распространения «агрессивных» штаммов вирусов и бактерий, прогнозировать возможность межвидовой передачи возбудителей и конструировать новые современные подходы к мерам профилактики и борьбы с патогеном.
Список литературы:
1. Башаров А. А., Юзлекбаев Ф. Ф., Юмагузин И. Ф. Оценка эффективности вакцин и дезинфектантов против клостридиоза коров на молочных комплексах республики Башкортостан. Вестник Красноярского государственного аграрного университета. 2023; (11 (200): 244-250. https://doi.org/10.36718/1819-4036-2023-11-244-250.
2. Безбородова Н. А., Томских О. Г., Кожуховская В. В. Методы профилактики клостридиальной инфекции крупного рогатого скота на территории Российской Федерации. Сибирский вестник сельскохозяйственной науки. 2023; (53 (8): 92-100.
3. Безбородова Н. А., Шилова Е. Н., Соколова О. В. Обнаружение и идентификация лабораторными методами бактериальных патогенов рода Clostridium, выявленных у крупного рогатого скота на территории Уральского региона. Российский журнал. Проблемы ветеринарной санитарии, гигиены и экологии. 2022; (1 (41): 83-92.
4. Белый Ю. Ф., Фиалкиа С. В., Троицкий В. И. Роль токсинов в патогенности Clostridium difficile. Экспериментальная и клиническая гастроэнтерология. 2018; (12 (160): 4-10.
5. Глотова Т. И., Терентьева Т. Е., Глотов А. Г. Возбудители и возрастная восприимчивость крупного рогатого скота к клостридиозам. Сибирский вестник сельскохозяйственной науки. 2017; (47): 90-96.
6. Данилюк А. В., Капустин А. В. Распространенность и видовое разнообразие клостридий - возбудителей анаэробных инфекций крупного рогатого скота. Труды Всероссийского НИИ экспериментальной ветеринарии им. Я.Р. Коваленко. 2019; (81): 19-26.
7. Дементьева М. С., Крысенко Ю. Г. Сравнительная экономическая эффективность схем иммунопрофилактики клостридиозов крупного рогатого скота. Научные разработки и инновации в решении стратегических задач агропромышленного комплекса: Материалы Международной научно-практической конференции. 2022: 149-153.
8. Капустин А. В., Лаишевцев А. И., Скляров О. Д. Разработка метода контроля иммуногенной активности ассоциированной вакцины против клостридиозов крупного рогатого скота. Russian Journal of Agricultural and Socio-Economic Sciences. 2017; (63 (3): 170-175.
9. Нечипуренко О. О. Опасность клостридиоза у коров. Наше сельское хозяйство. 2020; (6 (230): 50-53.
10. Пудовкин Д. Н. Профилактика клостридиозов крупного рогатого скота - комплексные и комплементарные решения. Молочное и мясное скотоводство. 2019; (5): 38-39.
11. Пулотов Ф. Х., Девришов Д. А. Сравнительная иммуногенная активность вакцины против клостридиозов животных. Ветеринария, зоотехния и биотехнология. 2019; (3): 43-48.
12. Пулотов Ф. Х., Девришов Д. А., Исматов И. А. Совершенствование технологии изготовления поливалентной вакцины против клостридиозов животных. Проблемы биологии продуктивных животных. 2020; (1): 34-43.
13. Редкозубова Л. Уберечь скот от клостридиоза. Животноводство России. 2018; (5): 55-57.
14. Ahmed H. A., Bayomi E., Hamed R. I. et al. Genetic relatedness, antibiotic resistance, and effect of silver nanoparticle on biofilm formation by Clostridium perfringens isolated from chickens, pigeons, camels, and human consumers. Vet Sci. 2022; (2): 9-10.
15. Al-Shukri M. S., Hmood A. M., Al-Charrakh A. H. Sequencing of Clostridium perfringens toxin genes (cpa, etx, iap) from Iraqi hospitals and detection by PCR of the genes encoding resistance to metronidazole, tetracycline, and clindamycin. Indian J Med Microbiol. 2021; (39 (3): 289-294.
16. Basseres E., Begum K., Lancaster C. In vitro activity of eravacycline against common ribotypes of Clostridioides difficile. J Antimicrob Chemother. 2020; (75 (10): 2879-2884.
17. Bendary M. M., Abd El-Hamid M. I., El-Tarabili R. M. Clostridium perfringens Associated with Foodborne Infections of Animal Origins: Insights into Prevalence, Antimicrobial Resistance, Toxin Genes Profiles, and Toxinotypes. Biology. 2022; (11 (4): 551.
18. Raymond K., Shabhonam C., Sarah A. Hall probing genomic aspects of the multi-host pathogen clostridium perfringens reveals significant pangenome diversity, and a diverse array of virulence factors. Microbiol. 2017.
19. Xiaoting W., Chengcheng N., Chunhui J. Antimicrobial resistance profiling and molecular typing of ruminant-borne isolates of Clostridium perfringens from Xinjiang, China. J Glob Antimicrob Resist. 2021; (27): 41-45.
20. Xiu L., Liu Y., Wu W. Prevalence and multilocus sequence typing of Clostridium perfringens isolated from 4 duck farms in Shandong province, China. Poult Sci. 2020; (99 (10): 5105-5117.
Сведения об авторах:
Порываева Антонина Павловна, доктор биологических наук, ведущий научный сотрудник лаборатории вирусных инфекций ФГБНУ «Уральский федеральный аграрный научно-исследовательский центр УрО РАН»; 620142, г. Екатеринбург, ул. Белинского, 112 а; e-mail: app1709@inbox.ru.
Шилова Евгения Николаевна, доктор ветеринарных наук, ведущий научный сотрудник лаборатории вирусных инфекций ФГБНУ «Уральский федеральный аграрный научно-исследовательский центр УрО РАН»; 620142, г. Екатеринбург, ул. Белинского, 112 а; e-mail: adelaida.gurgenovna@mail.ru.
Кожуховская Вероника Валентиновна, младший научный сотрудник отдела ОВЛД с ИЛ ФГБНУ «Уральский федеральный аграрный научноисследовательский центр УрО РАН»; 620142, г. Екатеринбург, ул. Белинского, 112 а; e-mail: tetramegon@yandex.ru.
Соколова Ольга Васильевна, доктор ветеринарных наук, ведущий научный сотрудник отдела геномных исследований и селекции животных ФГБНУ «Уральский федеральный аграрный научно-исследовательский центр УрО РАН»; 620142, г. Екатеринбург, ул. Белинского, 112 а; e-mail: nauka_sokolova@mail.ru.
Яцентюк Светлана Петровна, кандидат ветеринарных наук, заведующий отделом генодиагностики инъекционных болезней животных ФГБУ «Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов»; 123022, г. Москва, Звенигородское шоссе, 5; e-mail: pcr-lab@vgnki.ru.
Ответственный за переписку с редакцией: Безбородова Наталья Александровна, кандидат ветеринарных наук, старший научный сотрудник отдела геномный исследований и селекции животных ФГБНУ «Уральский федеральный аграрный научно-исследовательский центр УрО РАН»; 620142, г. Екатеринбург, ул. Белинского, 112а; тел.: 8-904-9817214; e-mail: n-bezborodova@mail.ru.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
http://vetkuban.com/num1_202501.html