УДК 636.09:579.62
Алешина Ю.Е., Мендыбаева А.М., Елеусизова А.Т., Рыщанова Р.М., Жабыкпаева А.Г.
Костанайский региональный университет имени Ахмета Байтурсынова,
Республика Казахстан, г. Костанай
Ежегодно все большее количество антимикробных препаратов используется для лечения мелких домашних животных, в том числе препараты, используемые в медицине человека (в частности цефалоспорины и фторхинолоны). Есть данные, что устойчивость к противомикробным препаратам растет среди бактерий, вызывающих инфекцию у домашних животных [11, 12].
ESBL - продуцирующие энтеробактерии (в-лактамазы расширенного спектра) относятся к основным микробиологическим опасностям, исходящих от домашних питомцев, то есть кошек и собак, которые прямо или косвенно могут вызывать неблагоприятные последствия для здоровья человека [6]. Передача таких микроорганизмов, происходит между домашними животными, владельцами и ветеринарным персоналом, где домашние животные могут выступать в качестве резервуаров бактерий, это создает возможности для межвидовой передачи резистентных форм бактерий, что в свою очередь может повлиять на использование антимикробных препаратов в медицине человека [7].
ESBL - продуцирующие энтеробактерии стали обнаруживать в 80-е годы прошлого века, с тех пор они превратились в возбудителей самых значимых инфекций различных систем организма как животных, так и человека [10]. Среди всех грамотрицательных бактерий, обладающих данным свойством особое место занимают Escherichia coli и Klebsiella поскольку из всего многообразия Enterobacteriaceae наиболее частыми продуцентами ESBL являются штаммы Klebsiella spp., в меньшей степени - Escherichia coli, реже продукция ESBL отмечается у других представителей семейства [4].
Многообразие в-лактамаз и их широкое распространение среди грамотрицательных возбудителей и, одновременно, ведущая роль в формировании устойчивости к антибиотикам, диктует необходимость их своевременного выявления. Продуцирование бета-лактамаз является основным механизмом формирования устойчивости грамот-рицательных бактерий к в-лактамным лекарственным средствам -к пенициллинам, цефалоспоринам I-V поколений. Инфекционные заболевания, вызываемые штаммами бактерий, резистентными к антибактериальным препаратам, отличаются длительным течением и ухудшают дальнейший прогноз болезни. Если препарат, применяемый при лечении болезни, не эффективен, то приходится использовать другие более сильные антимикробные средства, отличающиеся небезопасностью [1]. Все это повышает риск распространения резистентных штаммов микроорганизмов в окружающей среде [8].
Цель исследований - выделить из биоматериала собак и кошек и идентифицировать бактерии E. coli и Klebsiella, продуцирующие в-лак-тамазы с определением их антибиотикорезистентности.
Материалы и методы исследований. Материал для исследований брали в ветеринарных клиниках г. Костаная, лабораторные исследования проводили в отделе микробиологического анализа НИИ прикладной биотехнологии КРУ имени А. Байтурсынова.
Объектом исследований стал биологический материал от мелких домашних животных, клинически здоровых и с различной патологией кошек и собак. Всего исследовано 216 проб - смывы с ротовой полости, влагалища, анального отверстия и раневой поверхности.
Выделение и накопление чистых культур микроорганизмов проводили с применением универсальных хромогенных, дифференциально-диагностических сред. Идентификацию культур E. coli и Klebsiella выполняли согласно утвержденным методическим указаниям по микробиологической диагностике заболеваний, вызываемых энтеробактериями [2], а также в соответствии с определителем бактерий Берджи (1995).
Для выделения микроорганизмов из исследуемого материала делали посевы на МПБ, инкубировали в течение 18-20 ч при температуре 36-37°С, после чего делали пересев на чашки с хромогенной средой CHROMagarTM Orientation, которые вновь культивировали. При появлении четко выраженных колоний, характерных для роста E. coli и Klebsiella на данной среде, готовили мазки и окрашивали их по Граму. При обнаружении в мазках типичных по морфологии грамот-рицательных прямых палочек, с закругленными концами, изучали их биохимические свойства.
Способность бактерий к ферментации лактозы, глюкозы, а также к образованию газа и сероводорода определяли по изменению цвета среды, появлению пузырьков газа в среде Клиглера. Изменение среды учитывали после 24-часовой инкубации при температуре 37°С.
Ферментативные свойства бактерий изучали на средах Гисса с лактозой, маннитом. Утилизацию цитрата натрия при росте культуры, изучали по изменению окраски среды Симмонса, а образование индола - по появлению красного кольца на поверхности среды после добавления реактива Ковача (4-диметиламинобензальдегид, амиловый спирт и соляная кислота). Подвижность исследуемых изолятов изучали по их росту при посеве уколом в полужидкий агар. Изменение сред в процессе роста учитывали по истечению 2-х суток инкубации.
Проводили тест Фогес-Проскауэра, основанный на выявлении ацетоина, путем добавления а-нафтола и гидроксида калия (КОН) в 2-суточную культуру микроорганизмов на среде Кларка. В присутствии кислорода и КОН ацетоин окисляется в диацетил, образующий соединение красного цвета.
Тест с метиловым красным использовали для определенной концентрации ионов (pH) в среде у ферментирующих глюкозу микроорганизмов, путем добавления в культуру микроорганизма 5 капель индикатора метиловый красный и наблюдали за изменением цвета.
Для обнаружения индола проводили реакцию с применением реактива Ковача, путем его добавления в культуру микроорганизма на МПБ, при положительной реакции наблюдали образование красного кольца.
Антибиотикочувствительность выделенных изолятов E.coli и Klebsiella исследовали методом нанесения стандартных дисков антибиотиков на свежезасеянный газон культуры с использованием агара Мюллера-Хинтона. Учет результатов проводили после 18-24-часовой инкубации при температуре 37°С по наличию зон задержки роста микробов вокруг дисков, что, согласно инструкции, свидетельствует либо о чувствительности возбудителя к препарату, либо об устойчивости к данному антибиотику (табл. 1). Интерпретацию результатов проводили:
Таблица 1 Интерпретация результатов определения чувствительности Enterobacteriaceae
| № | Наименование дисков с препаратами | ≤R | I | S≥ | Интерпретация база |
|---|---|---|---|---|---|
| 1 | Ампициллин (10 мкг) | 14 |
| 14 | Eucast 11.0 |
| 2 | Амоксицилин (25 мкг) | 15 | 15-20 | 21 | НД-ПМП-1 |
| 3 | Цефоперазон (ЦПР) (75 мкг) | 15 | 16-20 | 21 | CLSI, МУК |
| 4 | Цефокситин (ЦФН) (30 мкг) | 9 |
| 19 | Eucast 11.0 |
| 5 | Цефподоксим (ЦФМ), 10 мкг | 17 |
| 17 | CLSI |
| 6 | Стрептомицин (10 мкг) | 11 | 12-14 | 15 | CLSI |
| 7 | Канамицин (30 мкг) | 13 | 14-17 | 18 | CLSI, МУК |
| 8 | Гентамицин (10 мкг) | 17 |
| 17 | Eucast 11.0 |
| 9 | Левомицетин (ЛЕВ), 30 мкг | 17 |
| 17 | Eucast 11.0 |
| 10 | Тетрациклин(30 мкг) | 19 |
| 19 | Eucast 11.0 |
| 11 | Доксициклин (30 мкг) | 0 | 11-13 | 14 | CLSI |
| 12 | Энрофлоксацин (ЭНР), 5 мкг | 17 | 18-21 | 22 | МУК |
| 13 | Ципрофлоксацин (ЦИП),5 мкг | 22 |
| 25 | Eucast 11.0 |
| 14 | Норфлоксацин (НОР), 10 мкг | 22 |
| 22 | Eucast 11.0 |
| 15 | Офлоксацин (ОФ), 5 мкг | 22 |
| 24 | Eucast 11.0 |
| 16 | Гемифлоксацин (ГЕМ), 5 мкг | 15 | 16-19 | 20 | CLSI |
| 17 | Налидиксоваякислота (НК), 30 мкг | 13 | 14-18 | 19 | CLSI |
| 18 | Триметоприм/ сульфаметоксазол 1,25/ 23,75 | 11 |
| 14 | Eucast 11.0 |
| 19 | Фуразолидон (ФРН), 300 мкг | 14 | 15-16 | 17 | CLSI |
| 20 | Фурадонин (ФД), 300 мкг | 14 | 15-16 | 17 | CLSI |
Для обнаружения бактерий, продуцирующих в-лактамазы был проведен посев на хромогенные среды (CHROMagarESBL, CHROMagarC3GR), обладающие высокой чувствительностью и специфичностью. Интерпретацию полученных результатов проводили в соответствии с инструкцией по использованию хромогенных сред.
Результаты исследований и их обсуждение. При проведении исследований из 216 проб биоматериала были выделены и изучены 78 изолятов энтеробактерий, из них 60 штаммов E. coli и 18 изоля-тов Klebsiella. Морфологические, тинкториальные и культуральные свойства выделенных изолятов были характерны для своего семейства и рода.
При окраске по Граму, бактерии представляли собой прямые с закругленными концами грамотрицательные палочки.
На CHROMagarTM Orientation рост культур кишечной палочки сопровождался образованием круглых колоний размером около 0,51 мм, от темно-розового до красноватого цвета, микроорганизмы рода клебсиелла образовывали колонии с неровными краями цвета синий металлик.
На среде Клиглера Escherichia coli росла с образованием пузырьков газа и с полным или частичным изменением цвета столбика и скоса с красного на желтый. У всех выделенных изолятов данного рода отмечали ферментацию лактозы и маннита и отсутствие роста на среде Симмонса и среде Кристенсена с мочевиной, разжижение желатина не наблюдалось. Реакция с метилротом была положительной, а Фогеса-Проскауэра - отрицательная.
Изоляты рода Klebsiella на комбинированной среде Клиглера росли с полным изменением цвета среды, без образования сероводорода. На среде Симмонса можно было наблюдать как полное изменение цвета среды, так и частичное, аналогично и с лактозой, окисление маннита было полной, разжижение желатина не наблюдалось. Реакция с метиленовым красным была положительной, реакция Фогеса-Проскауэра и индола скорее отсутствовала, нежели была положительной (табл. 2).
Таблица 2 Биохимические свойства, выделенных изолятов энтеробактерий
| Микроорганизм | Комбинированная среда (агар Клиглера) | Цитрат Симмонса | Лактоза | Маннит | Разжижение желатина | индол | мочевина | Реакция с метилротом | Реакция Фогеса-Проскауэра | |||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| лактоза | глюкоза | газ | сероводород | |||||||||
| Escherichia coli | +/- | +/- | + | - | - | + | + | - | + | - | + | - |
| Klebsiella | + | + | + | - | +/- | +/- | + | - | -/+ | +/- |
| -/+ |
Примечание: «+» - положительная реакция, «-» - отрицательная реакция, «+/-» - чаще положительная реакция, реже отрицательная, «-/+» - чаще отрицательная реакция, реже положительная.
Таблица 3 Результаты чувствительности/резистентности к антибиотикам штаммов Escherichia coli и Klebsiella
| Антибиотики | Микроорганизмы (%) | ||||||
|---|---|---|---|---|---|---|---|
| Группа | Препарат | E.coli | Klebsiella | ||||
| R | I | S | R | I | S | ||
| Бета-лактамы | Ампициллин | 38 | - | 61 | 61 | - | 39 |
| Амоксицилин | 40 | 27 | 33 | 67 | 22 | 11 | |
| Цефоперазон | 20 | 17 | 63 | 33 | 17 | 50 | |
| Цефокситин | 32 | - | 68 | 56 | - | 44 | |
| Цефподоксим | 75 | - | 25 | 89 | - | 11 | |
| Аминогликозиды | Стрептомицин | 6 | 2 | 92 | 17 | - | 83 |
| Канамицин | 10 | 8 | 82 | 23 | 5 | 72 | |
| Гентамицин | 15 | - | 85 | 22 | - | 78 | |
| Амфениколы | Левомицетин | 22 | - | 78 | 28 | - | 72 |
| Тетрациклины | Тетрациклин | 93 | - | 7 | 89 | - | 11 |
| Доксициклин | 70 | 12 | 18 | 94 | - | 6 | |
| Фторхинолоны | Энрофлоксацин | 40 | 12 | 48 | 34 | 11 | 55 |
| Ципрофлоксацин | 39 | 3 | 58 | 33 | 22 | 45 | |
| Норфлоксацин | 45 | - | 55 | 45 | - | 55 | |
| Офлоксацин | 69 | 2 | 25 | 61 | 6 | 33 | |
| Гемифлоксацин | 35 | 10 | 55 | 2 | 6 | 67 | |
| Хинолоны | Налидиксовая кислота | 31 | 7 | 62 | 38 | 6 | 56 |
| Сульфаниламиды | триметоприм/сульфаметоксазол | 26 | 2 | 72 | 28 | - | 72 |
| Нитрофураны | Фуразолидон | 3,5 | 3,5 | 93 | 17 | - | 83 |
| Фурадонин | - | 7 | 93 | 28 | 11 | 61 | |
Примечание: R - резистентные, I - промежуточные, S - чувствительные
Все выделенные изоляты микроорганизмов соответствовали биохимическим свойствам характерным для микроорганизмов вида Escherichia coli и рода Klebsiella.
Следующим этапом исследований было определение чувствительности к антибактериальным препаратам выделенных штаммов и определение профиля резистентности. Исследование профилей резистентности ценно в практике инфекционного контроля при определении механизмов резистентности.
Профиль резистентности штамма выстраивали вручную по результатам интерпретации диаметров зон подавления роста.
Исследования антибиотикорезистентности проведены у 60 выделенных изолятов кишечной палочки и 18 изолятов клебсиелл. Спектр определения составлял не менее 20 антибиотиков различных фармакологических групп. Выбор остановили на препаратах, которые являются представителями основных групп антибиотиков, наиболее часто используемых при лечении, как животных, так и человека.
Для тестирования выделенных культур применяли следующие группы препаратов:
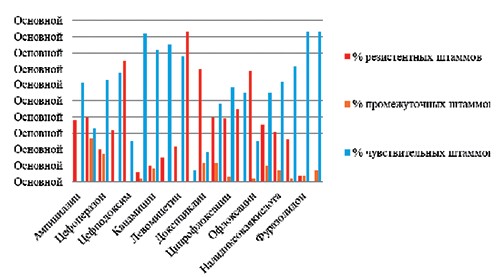
Результаты изучения чувствительности/резистентности изолированных штаммов к антибиотикам представлены в таблице 3 и рисунке 1.
Результаты исследований на чувствительность и резистентность выявленных микроорганизмов к антибиотикам показали, штаммы E. coli проявили наибольшую резистентность к антибактериальным препаратам группы тетрациклинов: к тетрациклину - 56 штаммов (93%), к доксициклину - 42 штамма (70%), а также группе бета-лакта-мов, а именно цефподоксиму - 45 штаммов (75%).
Меньше всего, у изолятов E. coli, резистентность была выражена к группе нитрафуранов, в частности к фуразолидону, она проявлялась у 2 изолятов, что составило 3,5%, а к фурадонину резистентность совсем отсутствовала. Помимо этого 6% изолятов были резистентны к действию стрептомицина (рисунок 1).

Рис. 1. Результаты резистентности штаммов Escherichia coli
При исследовании микроорганизмов рода Klebsiella, у 17 (94%) исследованных изолятов выявлена резистентность к доксициклину, относящемуся к группе тетрациклинов, 16 штаммов проявили резистентность к тетрациклину и цефподоксиму, что составило 89%, более 60% микроорганизмов были резистентны к ампицилину, амоксицик-лину, офлоксацину.
Наименее резистентны клебсиеллы были к группе аминогликозидов, а именно к стрептомицину и натрофуранам (фуразолидон), в обоих случаях этот показатель составил лишь 17% (3 изолята) (рис. 2).

Рис. 2. Результаты резистентности штаммов Klebsiella
Параллельно с определением чувствительности к антибактериальным препаратам проводили обнаружения бактерий, продуцирующих бета-лактамазы, путем посева на хромогенные среды (CHROMagar ESBL, CHROMagar C3GR), обладающие высокой чувствительностью и специфичностью (рис. 3). Результаты культивирования представлены в таблице 4.
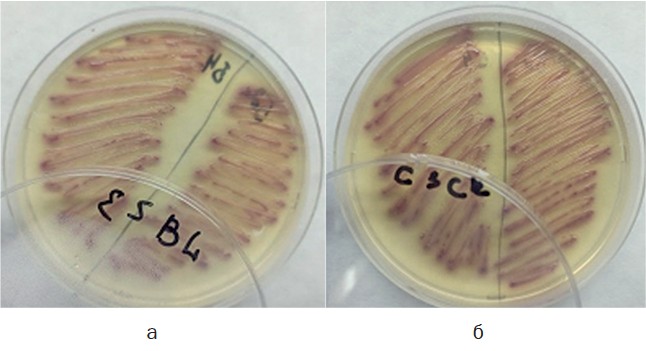
Рис. 3. Рост Escherichia coli, продуцирующей бета-лактомазы, на среде: а) CHROMagarESBL, б) CHROMagar C3GR
Таблица 4 Результаты определения микроорганизмов Enterobacteriaceae, продуцирующих бета-лактамазы (%)
| Наименование микроорганизма | Наименование среды | |
|---|---|---|
| ESBL | C3GR | |
| E.coli | 98% | 92% |
| Klebsiella | 94% | 94% |
В результате проведенных исследований при определении в-лакта-маза-продуцирующих E. coli обнаружено, что у 98% присутствует рост на среде ESBL и на среде C3GR у 92% палочек, что свидетельствует о том, что у данных микроорганизмов присутствует механизм устойчивости к бета-лактамным лекарственным препаратам.
При исследовании бактерий рода Klebsiella выявлено, что 94% микроорганизмов продуцируют в-лактамазы, о чем свидетельствует рост на среде CHROMagarESBL, CHROMagarC3GR.
Полученные данные изучения антибиотикорезистентности показали, что все 78 исследованных изолятов энтеробактерий проявляли устойчивость к двум и более антибиотикам, то есть были полирезис-тентными, монорезистентных форм, устойчивых только к одному из представленных антибиотиков, выявлено не было. Результаты исследований, на наш взгляд, свидетельствует о достаточно высоком уровне распространения первичной резистентности среди мелких домашних животных, то есть резистентность присутствует еще до начала проведения антибиотикотерапии, что может приводить к неэффективному лечению животных.
Проведённые исследования и полученные результаты позволяют сделать следующие выводы:
Научные исследования выполнены в рамках проекта «Распространенность детерминант устойчивости к антибактериальным препаратам» грантового финансирования Министерства образования и науки Республики Казахстан на 2021-2023 годы.
Список литературы:
Резюме. ESBL-продуцирующие энтеробактерии (в-лактамазы расширенного спектра) стали обнаруживать в 80-е годы ХХ века, с тех пор они превратились в возбудителей самых значимых инфекций различных систем организма, как животных так и человека. ESBL-продуцирующие энтеробактерии относятся к основным микробиологическим опасностям, исходящих от домашних питомцев, то есть кошек и собак, которые прямо или косвенно могут вызывать неблагоприятные последствия для здоровья человека. Среди всех грамотрицательных бактерий, обладающих данным свойством, особое место занимают Escherichia coli и Klebsiella. Авторами выделены и идентифицированы бактерии Escherichia coli и Klebsiella, продуцирующие в-лактамазы с определением их антибиотико-резистентности. Объектом исследований был биологический материал от мелких домашних животных (кошек и собак), взятый в ветеринарных клиниках г. Костаная. Всего исследованию было подвергнуто 216 проб. Из биологического материала были выделены и идентифицированы 78 микроорганизмов: E. coli (n=60) и Klebsiella (n=18). Спектр определения чувствительности микроорганизмов составлял не менее 20 антибиотиков различных фармакологических групп. В результате проведенных исследований все 78 изолятов энтеробактерий были полирезистентными, то есть проявляли устойчивость к двум и более антибиотикам. Штаммы Escherichia coli и Klebsiella проявили наибольшую резистентность к антибактериальным препаратам группы тетрациклинов и бета-лакта-мов. У большинства штаммов клебсиелл также была выявлена резистентность к фторхинолонам. Продуцирование в-лактамазы в среднем было выявлено у 95% Escherichia coli и у 94% Klebsiella.
Ключевые слова: энтеробактерии, Escherichia coli, Klebsiella, штаммы, антибиотикочувствительность, антибиотикорезистентность, в-лактамазы, хромогенные среды, CHROMagarESBL, CHROMagarC3GR.
Сведения об авторах:
Мендыбаева Анара Муратовна, магистр ветеринарных наук, менеджер по качеству Научно-исследовательского института прикладной биотехнологии Костанайского регионального университета имени А. Байтурсынова; 110000, Республика Казахстан, г. Костанай, ул. Маяковского 99/2; тел.: 8-707-1195732; e-mail: jks1992@mail.ru.
Елеусизова Анара Тулегеновна, кандидат ветеринарных наук, преподаватель кафедры ветеринарной санитарии Костанайского регионального университета имени А. Байтурсынова; 110000, Республика Казахстан, г. Костанай, ул. Маяковского 99/2.
Рыщанова Раушан Миранбаевна, кандидат ветеринарных наук, заведую ая отделом иммунобиологических исследований Научно-исследовательского института прикладной биотехнологии Костанайского регионального университета имени А. Байтурсынова; 110000, Республика Казахстан, г. Костанай, ул. Маяковского 99/2; тел.: 8-705-9595938; e-mail: raushan5888@mail.ru.
Жабыкпаева Айгуль Габысхановна, магистр ветеринарных наук, преподаватель кафедры ветеринарной медицины Костанайского регионального университета имени А. Байтурсынова; 110000, Республика Казахстан, г. Костанай, ул. Маяковского 99/2; тел.: 8-702-7971212.
Ответственный за переписку с редакцией: Алешина Юлия Евгеньевна, магистр ветеринарных наук, докторант Костанайского регионального университета имени А. Байтурсынова; 110000, Республика Казахстан, г. Костанай, ул. Маяковского, 99/2; тел.: 8-705-7264861; e-mail: juliya.240895@gmail.com.
http://vetkuban.com/num1_202208.html