УДК 591.169.2
DOI 10.33861/2071-8020-2021-1-30-32
Борхунова Е.Н., Надеждин Д.В. Федеральное государственное бюджетное образовательное учреждение
высшего образования «Московская государственная академия ветеринарной медицины и биотехнологии -
МВА имени К.И. Скрябина», г. Москва
Введение. Повреждения кожного покрова, особенно, длительно незаживающие или хронические раны, являются актуальной проблемой ветеринарной медицины [3]. Несмотря на большое количество средств природного и синтетического происхождения, обладающих репаративными свойствами, интерес к этой проблеме остается высоким, так как существующие препараты не всегда достаточно эффективны [1, 5].
Наиболее перспективным материалом для клеточной терапии дефектов кожи в настоящее время являются мультипотентные мезенхимные стромальные клетки (далее, ММСК) и стромально-васкулярная фракция (далее, СВФ) [2], способные путём паракринной продукции цитокинов, хемоаттрактантов и факторов роста стимулировать процесс регенерации [6, 8]. Являясь универсальными регуляторами регенераторного процесса, ММСК участвуют в заживлении раны практически на всех его стадиях: изменяют процесс течения воспаления, стимулируют пролиферацию эпителия и фибробластов, способствуют ангиогенезу [4, 6, 7].
Однако комплексная морфологическая оценка процесса репарации кожи в доступной литературе так и не обнаружена.
Цель исследования - на основании комплекса морфологических и морфометрических исследований выявить особенности заживления индуцированной раны кожи под влиянием аутологичной суспензии клеток стромально-васкулярной фракции и мультипотентных мезенхимных стромальных клеток.
Материалы и методы исследований. Исследования выполнены на базе кафедры анатомии и гистологии животных имени профессора А.Ф. Климова ФГБОУ ВО «Московская государственная академия ветеринарной медицины и биотехнологии - МВА имени К.И. Скрябина». Лабораторная часть морфологических исследований выполнялась на базе сектора патоморфологии ФГБНУ ВИЭВ имени Я.Р. Коваленко. Получение клеточных продуктов осуществлялось на базе Центра ветеринарной клеточной медицины. Объектом исследования служили гладкошерстные морские свинки, которых подразделяли на контрольную и опытные группы (по 20 особей в каждой). В области бедра с обеих сторон под аналгезией (Медитин 0,1%) наносили лоскутную рану (1,5*1,5 см). Заживление в группе контроль происходило естественным путем, в опытной группе (рана + СВФ) - под влиянием аутологичных клеток СВФ, а в группе (рана + ММСК) - под влиянием мультипотентных мезенхимальный стромальных клеток. Для получения аутологичных клеток у животных второй группы в межлопаточной области под местной анестезией (1% новокаин) производили липосакцию. Осуществляли введение суспензии клеток на 3-и сутки после нанесения раны в 4 точки (по 0,2 мл в каждую) в зону демаркации. Животные находились под динамическим наблюдением. На 7-е, 14-е и 30-е сутки проводили планиметрические исследования по методу Поповой и брали биопсии, которые заливали в парафин по общепринятой методике. Микропрепараты изучали с помощью микроскопа Jenamed-2, совмещенного с системой для цифрового анализа изображения ImageScope 4.0. При этом описывали общую морфологическую картину, а также проводили микроморфометрические исследования регенератов кожи по методике, разработанной Е.Н. Борхуновой (2004). Для объективной характеристики регенерата определяли количественные показатели: общую толщину, толщину эпидермиса, соединительнотканной части, слоя белой жировой ткани, в соединительнотканной части регенерата регистрировали толщину пучков коллагеновых волокон, количество фибробластов и кровеносных капилляров.
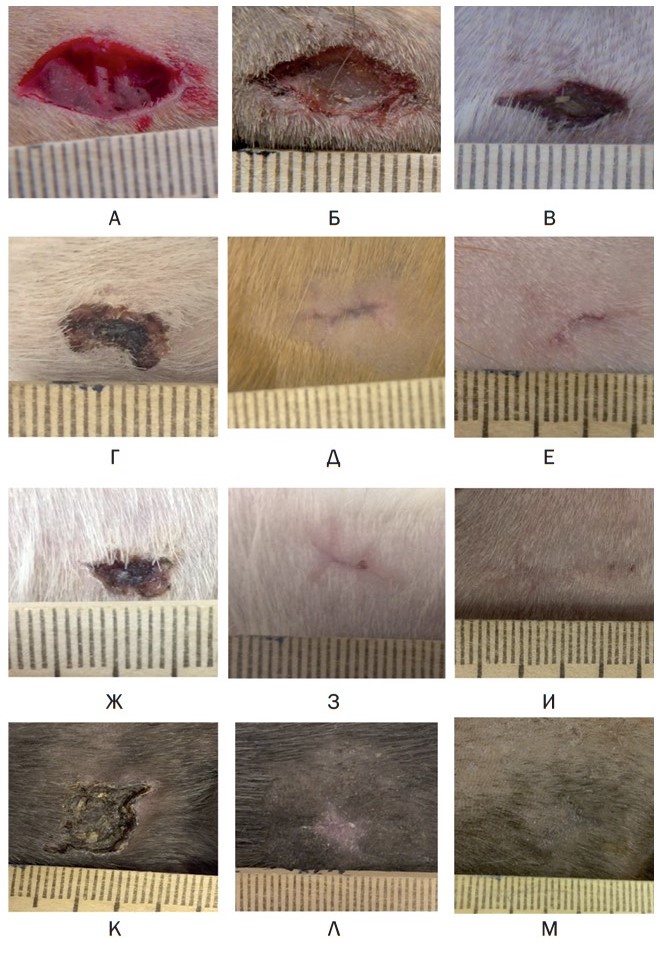
Результаты исследований и их обсуждение. Введение клеточных продуктов осуществлялось на 3-и сутки после нанесения раны, поэтому ниже приводится общее для исследованных групп описание до этого срока. Лоскутная рана овальной формы имела ровные края, дно было образовано двуглавой мышцей бедра и поверхностной фасцией (рисунок 1 а).
Через 24 часа отмечали контракцию раны. Края раны становились неровными, сухими, с умеренно выраженными гиперемией и отёком. Дно раны без признаков экссудации (рисунок 1 б). Через 3 суток контракция усугублялась, что приводило к значительному уменьшению площади раневого дефекта. Дно раны формировал сухой струп, по краям сохранялись и незначительная гиперемия, и умеренный отек (рисунок 1 в).

Рис. 1. Макроскопическая характеристика кожного покрова на разных этапах регенерации: А - сразу после нанесения, Б - на 1-е сутки, В - на 3-и сутки, Г - контроль, через 7 суток, Д - контроль, через 14 суток, Е - контроль, через 30 суток, Ж - опыт (рана+СВФ), через 7 суток, З - опыт (рана+СВФ), через 14 суток, И - опыт (рана+СВФ), через 30 суток, К - опыт (рана + ММСК), через 7 суток, Л - опыт (рана + ММСК), через 14 суток, М- опыт (рана + ММСК), через 30 суток
Через 7 суток в группе контроль уровень поверхности раневого дефекта приближался к таковому окружающей кожи, что свидетельствовало о заполнении его грануляциями. Поверхность дефекта была покрыта струпом, более толстым в центральной части и тонким на периферической (рисунок 1 г). На 14 сутки струп отторгался, на месте дефекта обнаруживался втянутый рубец, периферическая часть которого была бледной, а центральная - багровой. Волосяных фолликулов не обнаружено (рисунок 1 д). Через 30 суток рубец оставался втянутым и плотным, но его площадь значительно уменьшалась. Его центральная часть сохраняла темно-красное окрашивание, очевидно, за счет множества кровеносных сосудов, что соответствует морфологической незрелости рубцовой ткани. В периферической части отмечали рост волосяных фолликулов, что свидетельствовало о ремоделировании рубца (рисунок 1 е).
У животных группы (рана+СВФ) на 7 сутки рана была покрыта тонким струпом, края её сухие и неровные, внешние признаки демаркационного воспаления не выражены. Её размеры существенно уменьшались больше, чем в контроле (рисунок 1 ж).
Через 14 суток отмечали отторжение струпа. Постдеструктивная поверхность представлена тонким, мягким рубцом розового цвета, центральная часть которого более яркая, а периферическая - более бледная. Рубец тонкий, мягкий. Его площадь меньше таковой в контрольной группе (рисунок 1 з).
Через 30 суток площадь рубца существенно уменьшалась, по уровню поверхности и цвету он, за исключением центральной части, фактически не отличался от окружающего кожного покрова, что отличает его от рубца, сформировавшегося в контрольной группе. Лишь локально на площади рубца отсутствовали признаки роста волосяных фолликулов, периферическая часть в области заживления была сформирована регенератом, сходным с окружающей кожей (рисунок 1 и).
У животных опытной группы (рана + ММСК) на 7 сутки после операции рану, покрытую плотным струпом, отторгающимся по краям, что свидетельствует об эпителизации дефекта (рисунок 1 к). В отличие от контроля и группы «Рана+СВФ», дефект не углубленный («минус-ткань»), а, напротив, возвышался над уровнем поверхности кожи, что может указывать не только на толщину струпа, но и на более обильное развитие грануляций. Перифокально от дефекта визуализировали демаркационную зону с признаками умеренного отека и гиперемии.
Через 14 суток после операции отмечали отторжение струпа. В центре постдеструктивной поверхности наблюдали мягкий, лишенный волосяного покрова мягкий рубец светло-розового цвета. Периферическая часть регенерата утолщена, а при пальпации более плотная по сравнению с окружающей кожей. Наблюдается рост волосяного покрова. Площадь рубца меньше таковой в контрольной группе (рисунок 1 л).
Через 30 суток в области бывшего дефекта наблюдали регенерат, визуально сходный с окружающей кожей. В центре отмечена область «минус-ткани», представленная мягким тонким пигментированным рубцом. Все это свидетельствует об активном ремоделировании рубцовой ткани (рисунок 1 м).
Динамика морфометрических показателей кожи при заживлении лоскутной раны в изученных группах, представлены в таблице 1.
Таблица 1 Динамика микроморфометрических показателей кожи при заживлении, см2
| Группа | Срок эксперимента (сутки) и площадь раны и рубца, см2 | |||||
|---|---|---|---|---|---|---|
| Сразу после нанесения раны | 1 сутки (рана) | 3 сутки (рана) | 7 сутки (рана) | 14 (рубец) | 30 сутки (рубец) | |
| Контроль | 2,27±0,12 | 1,63±0,09 | 1,45±0,11 | 1,12±0,23 | 0,94±0,23 | 0,64±0,07 |
| Рана + СВФ | 2,24±0,11 | 1,64±0,08 | 1,13±0,075 | 0,88±0,11 | 0,58±0,24 | 0,08±0,015 |
| Рана + ММСК | 2,25±0,13 | 1,62±0,12 | 1,14±0,068 | 0,75±0,091 | 0,54±0,07 | 0,09±0,05 |
Заключение. Таким образом, в ходе репарации наиболее выраженные отличия между представителями контрольной и опытных групп зафиксированы на 14-е и 30-е сутки эксперимента. Они проявляются в площади рубца, формирующегося на месте раны. Площадь меньше во всех опытных группах по сравнению с контрольной. В качественных показателях регенерата: в опытных группах он при визуальном осмотре большей частью имеет сходство с окружающей кожей, лишь в центре его остается небольшой мягкий рубец, лишенный волосяного покрова. Это свидетельствует о более активном ремоделировании рубцовой ткани.
Список литературы:
Резюме. Повреждения кожного покрова, особенно, длительно незаживающие или хронические раны, являются актуальной проблемой ветеринарной медицины. Наиболее перспективным материалом для клеточной терапии дефектов кожи в настоящее время являются мультипотентные мезенхимные стромальные клетки и стромально-васкулярная фракция, способные стимулировать процесс регенерации. Авторами выявлены особенности заживления индуцированной раны кожи под влиянием аутологичной суспензии клеток стромально-васкулярной фракции и мультипотентных мезенхимных стромальных клеток на основании комплекса морфологических и морфометрических исследований. В условиях эксперимента на морских свинках авторами изучено течение репаративной регенерации кожи после нанесения лоскутной раны под влиянием клеточной суспензии из мультипотентных мезенхимных стромальных клеток и аутологичных клеток стромально-васкулярной фракции. Клеточный материал получали путем липосакции из области холки животного. Аутологичную жировую ткань использовали для приготовления клеточной суспензии, содержащей совокупность клеток (фибробласты, перициты, макрофаги, жировые клетки, эндотелиальные клетки), составляющих стромально-васкулярную фракцию. Полученные данные свидетельствуют о том, что применение клеточных продуктов приводит к более быстрому (по сравнению с контролем) заживлению дефекта, формированию регенерата, морфологически сходного с окружающей интактной кожей. В структуре регенерата микроскопически обнаруживали восстановление структурных зон кожи: эпидермиса, дермы и подкожной жировой клетчатки. В центральной части регенерата сохранялся небольшой участок рубцовой структуры, площадь которого достоверно меньше, чем у контрольных аналогов. Авторами сделан вывод о том, что применение клеточных продуктов усиливает процессы репаративной регенерации и является эффективным способом воздействия при лечении кожных ран.
Ключевые слова: кожа, ткань, рана, регенерат, рубец, ремоделирование, репаративная регенерация, аутологичные клеточные продукты, стромально-васкулярная фракция, мультипотентные мезенхимные стромальные клетки.
Сведения об авторах:
Борхунова Елена Николаевна, доктор биологических наук, профессор кафедры анатомии и гистологии животных имени профессора А.Ф. Климова ФГБОУ ВО «Московская государственная академия ветеринарной медицины и биотехнологии - МВА имени К.И. Скрябина»; 109457, г. Москва, ул. Зеленодольская, 17, корп. 4, кв. 23; тел.: 8-916-7175715; e-mail: borhunova@mail.ru.
Ответственный за переписку с редакцией: Надеждин Дмитрий Витальевич, аспирант кафедры анатомии и гистологии животных имени профессора А.Ф. Климова ФГБОУ ВО «Московская государственная академия ветеринарной медицины и биотехнологии -МВА имени К.И. Скрябина»; 140163, Московская область, Раменский район, п. Дубки, 7, кв. 8; тел.: 8-901-3609867; e-mail: nadaki@mail.ru.
http://vetkuban.com/num1_202109.html