УДК 619:616.992.228.4
DOI 10/33861/2071-8020-2020-1-23-25
Дробин Ю.Д., Солдатенко Н.А., Фетисов Л.Н., Сазонова Е.А. СКЗНИВИ - филиал ФГБНУ ФРАНЦ, г. Новочеркасск
Черных О.Ю. ГБУ КК «Кропоткинская краевая ветеринарная лаборатория», г. Кропоткин
Лысенко А.А. ФГБОУ ВО «Кубанский государственный аграрный университет имени И.Т. Трубилина», г. Краснодар
Введение. Для населения всего мира загрязнение зерновых продуктов микотоксинами представляет собой растущую угрозу здоровью [1, 5]. Причем, если для животных опасность связана только с использованием контаминированного зерна, то для людей опасность таится и в зерновых продуктах, и в продуктах животного происхождения, особенно в субпродуктах (печень, почки), полученных от животных, которым некоторое время скармливали контаминированные микотоксинами корма.
Фузариотоксины относятся к самым распространенным в мире микотоксинам, а среди них - дезоксиниваленол (далее, ДОН), зе-араленон (ЗЛ) и фумонизин (ФУМ В1). Захарова Л.П. и Седова И.Б. (2007) показали, что в отдельные годы в Северо-Кавказском регионе частота обнаружения ДОН может достигать 100% [3].
Цитринин и охратоксин А относятся к нефротоксинам [3]. Возможность изучения распространения цитринина с помощью ИФА появилась в 2003 году. Мониторинг кормов, проведенный сотрудниками ВНИИВСГЭ, выявил цитринин среди всех видов кормов с частотой встречаемости до 10,5% в отдельных видах кормов. К настоящему моменту известно видовое разнообразие продуцентов цитринина, относящихся к родам Penicillium (P. expansum Link., P. citreonigrum Dierkx, P. verrucosum Dierkx chemotype II), Aspergillus (A. candidus Link., A. carneus, A. terreus Thom) и Monascus (M. purpureus, M. ruber). Эти микромицеты способны развиваться практически на любых видах продукции и растениеводства и животноводства [4]. Существует несколько подходов к решению проблемы микотоксикозов. Первый из них связан с предотвращением формирования микотоксинов в кормах ещё в период вегетации кормовых растений. На стадии хранения кормов используются стратегии, основанные на микробной или термической инактивации токсинов, физическом удалении загрязненных компонентов, обработке радиацией, озоном, аммиаком и другими физическими и химическими способами. Наряду с другими стратегиями предотвращения отрицательного действия микотоксинов, многие ученые и специалисты использовали манипуляции с питанием для улучшения защиты животных от микотоксинов и снижения негативных последствий от их потребления. При оценке эффективности той или иной стратегии предотвращения развития отрицательных эффектов воздействия на животный организм микотоксинов необходимо иметь ясное представление о способности отдельных микотоксинов кумулироваться в органах и тканях животных, о клинической и патолого-анатомической картине конкретного микотоксикоза у разных видов животных и птицы.
Целью исследований стало изучение патоморфологических изменений у цыплят-бройлеров при экспериментальном ДОН-токсикозе и экспериментальном цитринин-токсикозе.
Материалы и методы исследований. Изучали влияние микотоксинов ДОН и цитринин на организм цыплят-бройлеров в результате скармливания кормов, зараженных вышеуказанными микотоксинами. Продолжительность острого опыта составила 7 суток. Для эксперимента были сформированы 3 группы цыплят по принципу пар-аналогов: 2 опытные и 1 контрольная. В каждой группе было по 30 голов цыплят-бройлеров с 1-го дня жизни. Содержание микотоксинов в кормах определяли методом конкурентного иммуноферментного анализа [2, 4]. В экстрактах кормов определяли наличие микотоксинов: фузариотоксины (Т-2 токсин, фумонизин В1, зеараленон, ДОН), аспергилотоксины (афлатоксин В1, стеригматоцистин, охратоксин А) и пенициллотоксин (цитринин). Содержание микотоксинов в тканях внутренних органов определяли в соответствии с «Методическими рекомендациями по определению охратоксина А в органах и тканях животных с применением иммуноферментного анализа» [2]. Пато-морфологические изменения у цыплят бройлеров изучали традиционными методами [1].
Результаты исследований и их обсуждение. В результате определения уровня контаминации микотоксинами кормов были выбраны три типа образцов. Для воспроизведения ДОН-токсикоза был использован образец корма № 1, в котором содержание ДОН составляло 998 мкг/кг, что превышает максимально допустимый уровень (МДУ=350 мкг/кг) для цыплят более чем в 2 раза. Для воспроизведения экспериментального цитрининотоксикоза использовали образец корма № 2, контаминированный цитринином в концентрации 420 мкг/кг, что превышает МДУ (20 мкг/кг) более чем в 20 раз.
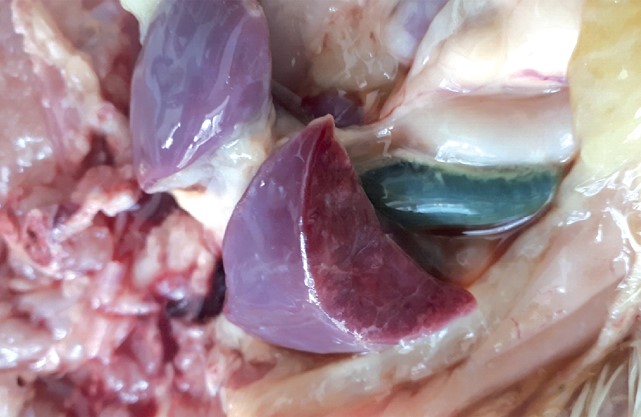
Результаты экспериментального воспроизведения микотоксикозов у цыплят-бройлеров. В 1-й опытной группе, цыплятам которой с первого дня жизни давали корм, загрязненный микотоксином ДОН, с уровнем загрязнения, превышающим МДУ в 2,5 раза, на второй день скармливания цыплята заболели с признаками диареи и примесью крови в помёте, были угнетены, плохо поедали корм. Уровень заболеваемости к 7 дню скармливания контаминированного корма достиг 83,3% (25 голов), смертность - 52,2% от числа заболевших. При вскрытии погибших цыплят установили, что печень кровенаполнена, с участками некроза, жёлчный пузырь переполнен желчью (рисунок 1), мышечная стенка предсердий истончена (рисунок 2).

Рис. 1. Печень цыпленка-бройлера при ДОН-токсикозе (1-я опытная группа)
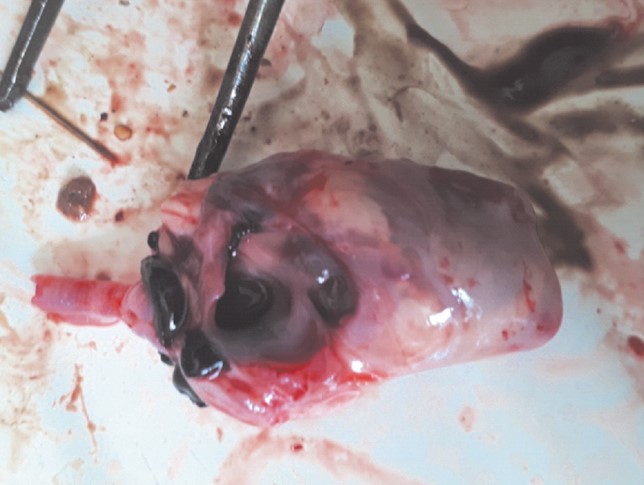
Рис. 2. Сердце цыпленка-бройлера при остром ДОН-токсикозе (1-я опытная группа)
При экспериментальном цитринин-токсикозе у цыплят во 2-й группе, также как и в первой, наблюдали диарею с примесью крови, а на вскрытии - воспаление тонкого и толстого отделов кишечника (рисунок 3), печень кровенаполнена, кишечник гиперемирован (рисунок 4).
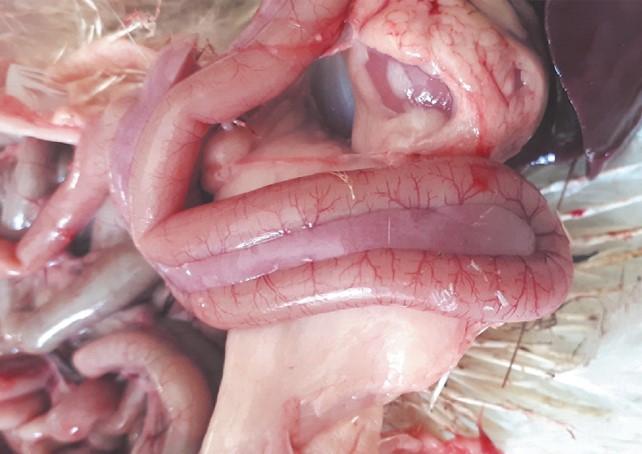
Рис. 3. Кишечник цыпленка-бройлера при цитринин-токсикозе (2-я опытная группа)
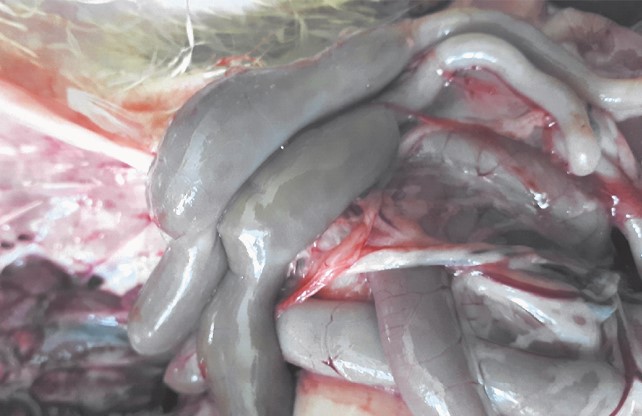
Рис. 4. Толстый кишечник цыпленка-бройлера при цитрининотоксикозе (2-я опытная группа)
В группе контроля, где цыплята получали корм без микотоксинов, все цыплята были живы, активны, сохраняли хороший аппетит в течение всего периода наблюдения. Для контроля уровня остаточных количеств микотоксинов исследовали печень и почки павших и убитых после окончания опытов цыплят опытных и контрольных групп (табл. 1).
Таблица 1. Схема проведения эксперимента по определению связывания микотоксинов модифицированными хитозанами
| Органы | Содержание микотоксинов, мкг/кг | ||
|---|---|---|---|
| Зеараленон | ДОН | Цитринин | |
| Печень и почки, группа 1 | 5,51 | 68,7 | 7,83 |
| Печень и почки, группа 2 | 5,96 | 0 | 6,76 |
| Печень и почки, контроль | 0 | 0 | 0 |
Значимые количества в пределах границ чувствительности метода достоверно установлены для дезоксиниваленола, то есть факт накопления этого микотоксина в органах цыплят 1-й опытной группы можно считать установленным. Показатели по содержанию других микотоксинов недостоверны.
Заключение. Проведенными исследованиями установлено, что наличие в корме дезоксиниваленола (ДОН) вызывает у цыплят-бройлеров гепатит, геморрагический энтерит. Характерным признаком острого ДОН-токсикоза можно считать миокардиодистрофию, в особенности левого предсердия, вплоть до прободения стенки предсердия (наблюдали в 8 случаях у 13 вскрытых цыплят). Наличие цитри-нина в кормах вызывает у цыплят-бройлеров поражение почек и катарально-геморрагический энтероколит, который сопровождается диареей с примесью крови. Достоверно установлен для дезоксини-валенола факт накопления этого микотоксина в органах цыплят 1-й опытной группы.
Список литературы:
Резюме. В представленной статье проанализированы данные о влиянии микотоксинов на организм цыплят-бройлеров, с целью изучения опосредованного влияния субпродуктов, получаемых от птицы, которую кормили комбикормом, зараженным микотоксинами, поступающей в пищу людям. В частности доказано, что при экспериментальном ДОН-токсикозе и экспериментальном цитринин-токсикозе у цыплят бройлеров данные токсины способны кумулироваться в органах и тканях и вызывать клинические и патологоанатомические изменения. Для воспроизведения ДОН-токсикоза был использован корм № 1, в котором содержание ДОН составляло 998 мкг/кг, что превышало максимально допустимый уровень для цыплят, более чем в 2 раза. Для воспроизведения экспериментального цитрининотоксикоза использовали корм № 2, контаминированный цитринином в концентрации 420 мкг/кг, что превышало МДУ более чем в 20 раз. В первой опытной группе уровень заболеваемости птицы к 7 дню скармливания контаминированного корма достиг 83,3%, смертность - 52,2% от числа заболевших. При вскрытии погибших цыплят авторами установлено, что печень кровенаполнена, с участками некроза, жёлчный пузырь переполнен желчью. Мышечная стенка предсердий истончена. При экспериментальном цитринин-токсикозе у цылят также как и в первой опытной группе наблюдали диарею с примесью крови, а на вскрытии - воспаление тонкого и толстого отделов кишечника, печень кровенаполнена, кишечник гиперемирован. Для ДОН достоверно установлен факт накопления этого микотоксина в тканях органов цыплят 1-й группы. Данные по накоплению в органах и тканях цыплят-бройлеров других микотоксинов в наших опытах оказались недостоверны и требуют дополнительных исследований.
Ключевые слова: корма, зерно, микотокисны, фузариотоксины , дезок-синиваленол (ДОН), зеараленон (ЗЛ), фумонизин (ФУМ В1), геморрагический энтерит, цыплята-бройлеры, экспериментальный ДОН-токсикоз, поражения печени, поражения почек.
Сведения об авторах:
Дробин Юрий Дмитриевич, кандидат ветеринарных наук, директор ФГБ-НУ «Северо-Кавказский зональный научно-исследовательский ветеринарный институт» - филиал ФГБНУ «Федеральный Ростовский Аграрный Научный Центр»; 346421, Ростовская область, г. Новочеркасск, ул. Ростовское шоссе, 0; e-mail: skznivi@novoch.ru.
Солдатенко Николай Александрович, кандидат ветеринарных наук, ведущий научный сотрудник ФГБНУ «Северо-Кавказский зональный научно-исследовательский ветеринарный институт» - филиал ФГБНУ «Федеральный Ростовский Аграрный Научный Центр»; 346421, Ростовская область, г. Новочеркасск, ул. Ростовское шоссе, 0; e-mail: buh.skzniwi@mail.ru.
Фетисов Леонид Николаевич, кандидат ветеринарных наук, ведущий научный сотрудник ФГБНУ «Северо-Кавказский зональный научно-исследовательский ветеринарный институт» - филиал ФГБНУ «Федеральный Ростовский Аграрный Научный Центр»; 346421, Ростовская область, г. Новочеркасск, ул. Ростовское шоссе, 0; e-mail: leonidfetisow@yandex.ru.
Сазонова Екатерина Александровна, научный сотрудник ФГБНУ «Северо-Кавказский зональный научно-исследовательский ветеринарный институт» - филиал ФГБНУ «Федеральный Ростовский Аграрный Научный Центр»; 346421, Ростовская область, г. Новочеркасск, ул. Ростовское шоссе, 0; e-mail: yek.sazonowa2013@yandex.ru.
Черных Олег Юрьевич, доктор ветеринарных наук, директор ГБУ КК «Кропоткинская краевая ветеринарная лаборатория»; 352380, г. Кропоткин, ул. Красноармейская, 303; тел.: 8-918-4956659; е-mail: gukkvl50@kubanvet.ru.
Ответственный за переписку с редакцией: Лысенко Александр Анатолиевич, доктор ветеринарных наук, профессор, профессор кафедры терапии и фармакологии ФГБОУ ВО «Кубанский государственный аграрный университет имени И.Т. Трубилина»; 350089, г. Краснодар, ул. Рождественская набережная, 29, кв. 7; тел.: 8-961-5075415; e-mail: vetkubgau@mail.ru.
http://vetkuban.com/num1_202006.html