УДК 619:579.62:615.9
DOI 10.33861/2071-8020-2020-1-19-22
Красочко П.А., Красочко И.А. УО «Витебская орДена «Знак Почёта» государственная
академия ветеринарной медицины», г. Витебск, Республика Беларусь
Албулов А.И. ФГБУ «Всероссийский научноисследовательский и технологический институт
биологической промышленности», Московская область, Щелковский р-н, пос. Биокомбината
Дубинич В.Н., Дубинич М.В. УО «ГроДненский государственный аграрный университет», г. Гродно, Республика Беларусь
Черных О.Ю.ГБУ КК «Кропоткинская краевая ветеринарная лаборатория», г. Кропоткин
Введение. Токсичные метаболиты микромицетов являются наиболее часто встречаемыми контаминантами кормов.
Как правило, они обладают дозозависимым действием, что приводит к появлению острых и хронических микотоксикозов у сельскохозяйственных животных, а также птицы.
Недополучение животноводческой продукции, её загрязнение микотоксинами, рождение слабого потомства, увеличение сервис периодов, возникновение рисков связанных с прорывом поствакцинального иммунитета, разработке новых средств диагностики и профилактики, снижение качества продукции - всё это приводит к значительным экономическим потерям. Так, по данным Организации по продовольствию и сельскому хозяйству при ООН (FAO), количество загрязненного зерна микотоксинами в мире достигает 25% от произведенного количества [7, 8]. Ежегодные суммарные затраты, связанные с диагностикой, профилактикой и уничтожением загрязнённых кормов и продуктов питания, составляют сотни миллионов долларов.
Наиболее эффективным способом профилактики микотоксикозов является адсорбция микотоксинов в желудочно-кишечном тракте животных специальными кормовыми добавками - адсорбентами микотоксинов. Эффективность адсорбента обусловлена рядом специфических показателей: коротким периодом адсорбции, высоким сродством как к полярным, так и неполярным микотоксинам, минимальной десорбцией при прохождении по пищеварительному тракту животного [1].
Непосредственно адсорбция проходит с физическим и/или химическим взаимодействиями между адсорбентом и адсорбатом. Физическая адсорбция обусловлена образованием межмолекулярных связей и считается менее прочной нежели хемосорбция, так как происходит без существенного изменения молекул адсорбата. В свою очередь, хемосорбция протекает с формированием новых химических связей и изменением структур атомов и молекул, что можно сравнить с течением химической реакцией ограниченной поверхностью адсорбента [3, 6]. В этом отношении, достаточно интересным адсорбентом является модифицированный хитозан. Непосредственно хитозан является производным линейного полисахарида - хитина и является единственным природным катионным полисахаридом [6].
В последнее время хитозан достаточно глубоко изучается в медицине, ветеринарии, используется как биологически активная добавка как в питании людей, так и в рационах животных. Его действие обусловлено способностью связывать эндо- и экзотоксины, стимулировать клеточный и гуморальный иммунитет, а являясь полисахаридом способен выполнять роль пребиотика [2, 4, 5].
Целью наших исследований было сконструировать комплексный адсорбент микотоксинов, и для её достижения были поставлены следующие задачи:
1) определить общую сорбционную ёмкость различных веществ органического и неорганического происхождения, и на основании полученных результатов определить круг компонентов комплексного адсорбента;
2) выявить степень сорбции и десорбции in vitro модифицированного хитозана к регламентируемым микотоксинам;
3) сравнить общую сорбционную ёмкость комплексного адсорбента микотоксинов с пре- и пробиотическими свойствами «Биотокс», содержащий различное количество сукцинат хитозана - 3% и 10%.
Материалы и методы исследований. Научно-исследовательская работа проводилась в условиях кафедры микробиологии и эпизоотологии УО «Гродненский государственный аграрный университет» (г. Гродно), кафедр эпизоотологии и инфекционных болезней, микробиологии и вирусологии УО «Витебская ордена «Знак Почета» государственная академия ветеринарной медицины» (г. Витебск).
Величину общей сорбционной ёмкости определяли по равновесной сорбции метиленового голубого определяли с помощью фотоэлектроколориметра, при длине волны 400 нм. Оптическую плотность измеряли в кюветах с гранями 10 мм. В качестве контрольного раствора использовали дистиллированную воду. Концентрация рабочего раствора составляла 600 мг/дм3.
В две конические колбы объёмом 250 мл внесли навески адсорбента по 0,3 г и поместили в сушильный шкаф при 105°С на 4 часа. По окончании высушивания и охлаждения до комнатной температуры навески заливались 50 мл рабочего раствора и перемешивались лёгким круговым движением. Затем пробы помещались в термостат на 5 ч при температуре 25°С. По истечении периода термостатирования отбирали 4 мл надосадочной жидкости после чего центрифугировали 30 мин при 6000 об/мин для осаждения частиц адсорбента.
Надосадочную жидкость десятитикратно разводили, после чего определяли оптическую плотность раствора на ФЭК.
По предварительно построенному калибровочному графику определили равновесную концентрацию метиленового голубого и рассчитали величину сорбции по формуле:
A = (600 - Cr x K) х 0,05/g;
где:
600 - начальная концентрация метиленового голубого (мг/дм3),
Cr - равновесная концентрация метиленового голубого (мг/дм3),
К - коэффициент разведения,
0,05 - исследуемый объем рабочего раствора (дм3),
g - навеска сухого вещества (г).
Определение степени связывания микотоксинов модифицированным хитозаном заключался в смешивании навесок хитозана с контрольными пробами производства ReedaFarm и дальнейшего исследования согласно прилагаемых методик (табл. 1).
Таблица 1. Схема проведения эксперимента по определению связывания микотоксинов модифицированными хитозанами
| Исследуемые образцы | Масса навески, г | Количество вносимых микотоксинов, мкг | |||||
|---|---|---|---|---|---|---|---|
| AFB1 | ОТА | FUM | DON | Т-2 | ZEA | ||
| Хитозан 1 (сукцинат хитозана) | 0,01 | 0,05 | 0,4 | 6 | 6 | 0,4 | 0,4 |
| Хитозан 2 (высокомолекулярный хитозан) | 0,01 | 0,05 | 0,4 | 6 | 6 | 0,4 | 0,4 |
| Хитозан 3 (низкомолекулярный хитозан) | 0,01 | 0,05 | 0,4 | 6 | 6 | 0,4 | 0,4 |
После пятиминутной экспозиции проводили реакцию твёрдотельного иммуноферментного анализа, определяя остатки вторичных метаболитов микромицетов. Для выявления процессов десорбции смешанные пробы исследовались повторно спустя 40 минут.
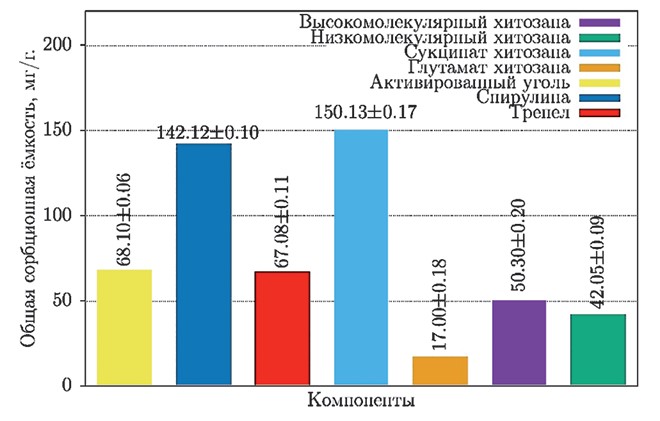
Результаты исследований и их обсуждение. Для конструирования комплексного адсорбента микотоксинов нами была изучена общая сорбционная ёмкость (рисунок 1) как неорганичесских (трепел, активированный уголь), так и органических компонентов (сукцинат хитозана, глутамат хитозана, низко- и высокомолекулярный хитозаны, спирулина).

Рис. 1. Общая сорбционная ёмкость органических и неорганических компонентов
В результате проведенных исследований нами установлено, что наиболее высокая общая сорбционная ёмкость у сукцинат хитозана - 150,13±0,17 мг/г, а минимальная - 17,00±0,18 мг/г - у глутамат хитозана, разница в процентном отношении составляет 88,68%. Высоко- и низкомолекулярный хитозаны имели сопоставимые значения сорбционной ёмкости - 50,30±0,20 мг/г и 42,05±0,09 мг/г, что ниже ёмкости сукцинат хитозана на 66,49% и 72%, соответственно.
Достаточно высокой сорбционной ёмкостью обладает высушенная спирулина - 142,12±0,10 мг/г, что ниже на 5,34% в сравнении с сукцинат хитозаном, и выше ёмкости активированного угля в 2,08 раза.
Активированный уголь и трепел имели сходную сорбционную ёмкость: 68,10±0,06 мг/г и 67,08±0,11 мг/г, что в процентном отношении ниже, чем у сукцинат хитозана.
Значительное колебание результатов сорбционной ёмкости различных модификаций хитозана возможны в результате неравной длины биополимерной цепи, а также в связи с наличием различных радикальных групп и их способности в формировании новых химических связей.
Сорбция афлатоксина В1 модификациями хитозана протекала с различной интенсивностью (рисунок 2).
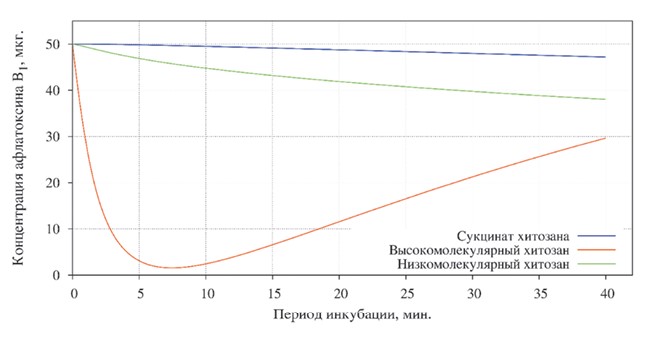
Рис. 2. Степень адсорбции афлатоксина В1 различными формами хитозана
Так, при первичном исследовании после пятиминутной инкубации максимальное снижение концентрации наблюдалось в пробе с высокомолекулярным хитозаном - первоначальная концентрация снизилась на 94,46%. В то же время сорбционная активность двух других образцов была значительно хуже: связывание афлатоксина В1 с сукцинат хитозаном не произошло. Степень адсорбции низкомолекулярным хитозаном была несущественна - концентрация микотоксина в пробе снизилась на 12,8%.
При заключительном этапе исследований, после сорокаминутной экспозиции, было выявлено планомерное незначительное снижение концентрации афлатоксина В1 в пробе с сукцинат хитозаном, которое составило 5,62%. Концентрация в пробе, содержащей низкомолекулярный хитозан, составила 38,04±0,003 мкг/кг (Р<0,01), что меньше первоначальной концентрации афлатоксина на 23,92%.
Изменение содержания афлатоксина В1 в пробе с высокомолекулярным хитозаном сопровождалось явлением десорбции.
Так, при повторном исследовании пробы количество несвязанного микотоксина составило 29,66±0,002 мкг/кг (Р<0,01), что меньше первоначальной концентрации на 40,68%.
После пятиминутной экспозиции концентрация адсорбированного ДОН (рисунок 3) в растворе, содержащем сукцинат хитозана, составила 93,0%, а в пробах с высоко- и низкомолекулярным хитозаном - 91,83%. Таким образом, интенсивность адсорбции в первые 5 минут экспозиции с сукцинат хитозаном была несколько выше.
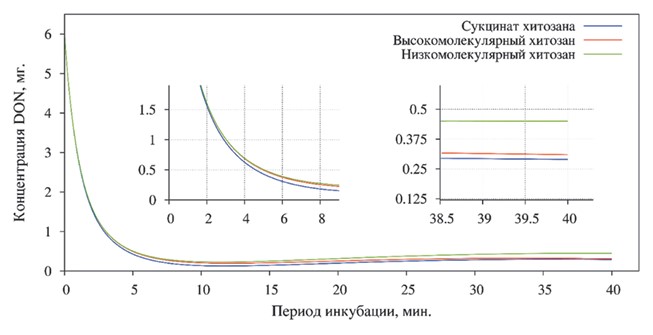
Рис. 3. Степень адсорбции дезоксиниваленола различными формами хитозана
Проводя исследование степени десорбции, после сорокаминутной экспозиции, было установлено снижение концентрации дезоксинива-ленола во всех пробах. В растворе, содержащем сукцинат хитозана, концентрация составила 0,29±0,002 мг/кг (Р<0,01), что свидетельствует об адсорбции 95,17% дезоксиниваленола от вносимой концентрации.
Уровень ДОНа в пробах с высоко- и низкомолекулярным хитозаном был несколько выше и составлял 0,31±0,005 мг/кг (Р<0,01) и 0,45±0,002 мг/кг (Р<0,01), соответственно. Таким образом, концентрация дезоксиниваленола была снижена на 94,83% и 92,5% относительно первоначальной.
При постановке реакции с фумонизином (рисунок 4) после пятиминутной экспозиции, в пробе содержащей сукцинат хитозана концентрация снизилась на 84,2%. В пробе с высокомолекулярным хитозаном количество фуманизина уменьшилось на 85%, а с низкомолекулярным уменьшение концентрации произошло несколько меньше и составило 83%.
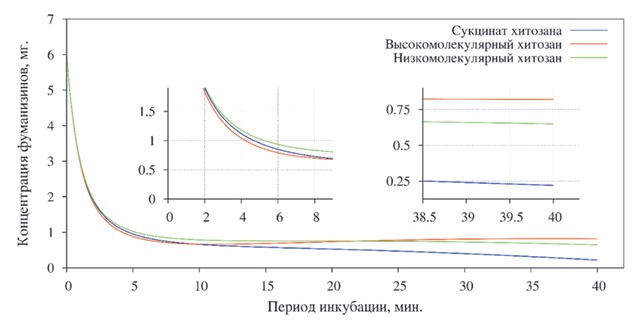
Рис. 4. Степень адсорбции фумонизинов различными формами хитозана
Максимально низкая концентрация при сорокаминутной экспозиции наблюдалась в пробе с сукцинат хитозаном: абсолютное значение составило 0,22±0,002 мг/кг (Р<0,01), что меньше от вносимой концентрации на 96,3%. Высоко- и низкомолекулярный хитозан уменьшили концентрацию на 86,2% и 89,2%, соответственно.
Содержание охратоксина А (рисунок 5) после пятиминутной экспозиции снизилось во всех исследуемых образцах, максимальное уменьшение концентрации наблюдалось в пробе с сукцинат хитозаном - 16,77±0,003 мг/кг (Р<0,01), что в процентном отношении соответствует уменьшению на 95,8%.
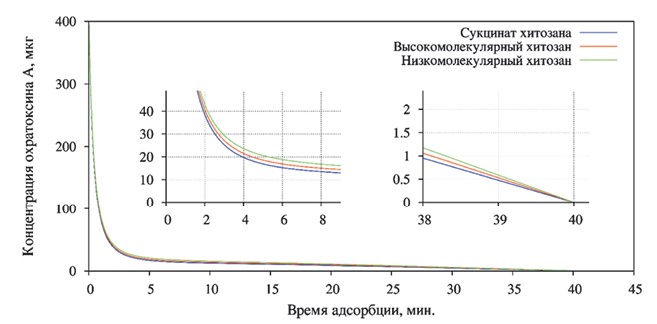
Рис. 5. Степень адсорбции охратоксина А различными формами хитозана
В то же время в пробах с высоко- и низкомолекулярным хитозаном концентрация охратоксина А составляла 18,63±0,003 мг/кг (Р<0,01) и 20,68±0,002 мг/кг (Р<0,01), что соответствует снижению концентрации микотоксина на 95,34% и 94,83%. После сорокаминутной экспозиции во всех пробах охратоксин А не обнаруживался.
Концентрация Т-2 токсина (рисунок 6) в пробах с сукцинат хитозаном снизилась на 92,72%, с высокомолекулярным хитозаном - на 93,17%, а с низкомолекулярным хитозаном - на 90,09%.
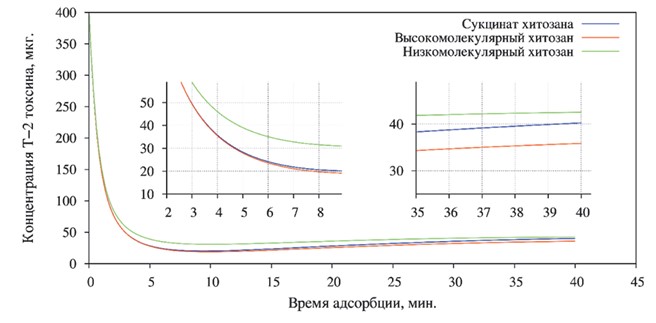
Рис. 6. Степень адсорбции Т-2 токсина различными формами хитозана
При повторном исследовании через 40 минут были обнаружены явления десорбции во всех пробах. Концентрация в пробе с сукцинат хитозаном увеличилась на 11,11 мг/кг, с высокомолекулярным хитозаном на 8,55 мг/кг, а с низкомолекулярным хитозаном на 2,89 мг/кг. То есть, процессы десорбции были минимальны в исследованиях с низкомолекулярным хитозаном. Однако, следует отметить, что минимальный уровень концентрации Т-2 токсина наблюдался в пробе с высокомолекулярным хитозаном и был ниже первоначально внесённого на 91,04%. Несколько хуже данный показатель был в пробе, содержащей сукцинат хитозана - 89,94%.
Минимальное количество Т-2 токсина было адсорбировано низкомолекулярным хитозаном, оно составило 89,37%, что сопоставимо с таковым результатом у сукцинат хитозана.
При постановке реакции для обнаружения остаточных количеств зеараленона (рисунок 7) минимальное значение наблюдалось в пробе с низкомолекулярным хитозаном - 5,78±0,003 мг/кг (Р<0,01), что меньше от первоначально внесенного на 98,56%. Несколько хуже процесс связывания зеараленона протекал с высокомолекулярным хитозаном - изменение концентрации составило 98,41%. Адсорбция сукцинат хитозаном микотоксина была наиболее слабой - 97,92%.
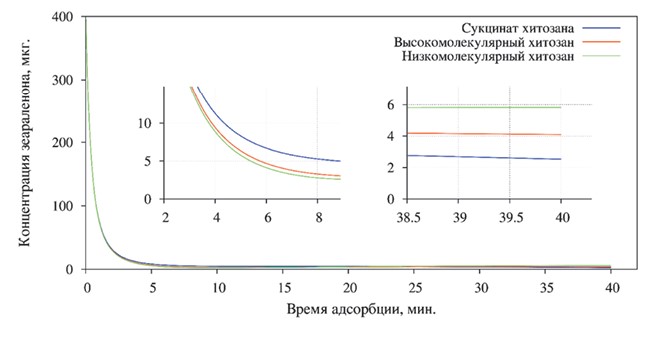
Рис. 7. Степень адсорбции зеараленона различными формами хитозана
При проведении заключительного исследования в пробе с низкомолекулярным хитозаном содержание зеараленона незначительно увеличилось, что может свидетельствовать о процессах десорбции: абсолютная величина составила 5,82±0,004 мг/кг (Р<0,01).
В оставшихся двух пробах процессы десорбции не наблюдались, а продолжилась фиксация зеараленона хитозаном. Так, в пробе, содержащей сукцинат хитозана, уменьшение составило 99,37% от первоначально внесенного количества микотоксина, а в пробе с высокомолекулярным хитозаном - 98,98%.
При конструировании комплексного адсорбента микотоксинов «Биотокс» с пре- и пробиотическими свойствами, в качестве сорбирующих компонентов были использованы трепел, как неорганический компонент, и сукцинат хитозана в качестве органического компонента. Данные сорбенты были подобраны на основании изложенных выше результатов исследований. В качестве пробиотического компонента были использованы штаммы лакто- и бифидобактерий.
Для определения оптимального соотношения трепела и хитозана были сконструированы две модификации «Биотокс», содержащие 3% и 10% сукцинат хитозана. При исследовании равновесной сорбции с метиленовым голубым были получены следующие результаты: общая сорбционная ёмкость «Биотокс» 3% составила 30,04±0,02 мг/ г, а «Биотокс» 10% - 91,3±0,05 мг/г. Следовательно, на основании этих данных, можно сделать заключение о том, что ведущую роль в связывании микотоксинов играет модифицированный хитозан. Также следует отметить, что при промышленном производстве, модификация содержащая 10% сукцинат хитозана, дороже в два раза «Биотокс» 3%.
Список литературы:
Резюме. Микотоксины являются вторичными низкомолекулярными метаболитами микромицетов. Данные соединения наиболее часто загрязняют корма и продукты растительного и животного происхождения. Описано более 400 микотоксинов из которых 47 являются высокотоксичными. Для профилактики микотоксикозов сельскохозяйственных животных и птицы в процессе интенсивного ведения животноводства используются органические, неорганические и комплексные адсорбенты микотоксинов. Сложность адсорбции вторичных метаболитов микромицетов вызвана разнородными физико-химическими свойствами как самих микотоксинов (полярностью молекул, молекулярной массой), так и адсорбентов. Нами были исследованы общие сорбционные ёмкости органических и неорганических компонентов для конструирования адсорбента микотоксинов и комплексного адсорбента микотоксинов «Биотокс», а также степень адсорбции и десорбции регламентируемых микотоксинов при взаимодействии с некоторыми модификациями хитозана. В результате проведенных исследований установлено, что наибольшей общей сорбционной ёмкостью обладает сукцинат хитозана (150,13±0,17) и спирули-на (142,12±0,10). При определении уровня адсорбции регламентируемых микотоксинов установлено, что все модификации хитозана достаточно эффективно связывают токсичные метаболиты микромицетов. Однако, на основании результатов исследований общей сорбционной ёмкости, данных по сорбции и десорбции микотоксинов и динамики процессов оптимальными показателями обладает сукцинат хитозана. Для конструирования комплексного адсорбента микотоксинов нами были использованы: трепел (в качестве минеральной составляющей), сукцинат хиозана (как органический адсорбент и в тоже время как пребиотик), лакто- и бифидобактерии для восстановления кишечной микрофлоры при микотоксикозах. Были разработаны адсорбенты с различным содержанием модифицированного хитозана: 3% и 10%, с общей сорбционной ёмкостью 30,04±0,02 мг/г. и 91,3±0,05 мг/г, соответственно.
Ключевые слова: хитозан, адсорбент, трепел, микотоксины, афлатоксины, охратоксины, дезоксиниваленол, зеараленон, Т-2 токсин, фумонизины.
Сведения об авторах:
Красочко Пётр Альбинович, доктор ветеринарных наук, доктор биологических наук, профессор, заведующий кафедрой эпизоотологии и инфекционных болезней УО «Витебская ордена «Знак Почёта» государственная академия ветеринарной медицины»; 210026, Республика Беларусь, г. Витебск, ул. 1-я Доватора 7/11; тел.: 8-0212-538075; e-mail: krasochko@mail.ru
Красочко Ирина Александровна, доктор ветеринарных наук, профессор кафедры микробиологии и вирусологии УО «Витебская ордена «Знак Почёта» государственная академия ветеринарной медицины»; 210026, Республика Беларусь, г. Витебск, ул. 1-я Доватора 7/11; тел.: 8-0212-515705; e-mail: krasochko@mail.ru.
Албулов Алексей Иванович, доктор биологических наук, профессор, заведующий отделом получения биологически активных веществ ФГБУ «Всероссийский научно-исследовательский и технологический институт биологической промышленности»; 141142, Московская область, Щелковский район, пос. Биокомбината; тел.: 8-496-5673263; e-mail: info@bioprogress.ru.
Дубинич Виктор Николаевич, старший преподаватель кафедры микробиологии и эпизоотологии УО «Гродненский государственный аграрный университет»; 230008, Республика Беларусь, г. Гродно, ул. Терешковой, 28; тел.: 8-10375152-623630; e-mail: ggau@ggau.by.
Дубинич Марина Валерьевна, старший преподаватель кафедры микробиологии и эпизоотологии УО «Гродненский государственный аграрный университет»; 230008, Республика Беларусь, г. Гродно, ул. Терешковой, 28; e-mail: viktordubinich@gmail.com.
Ответственный за переписку с редакцией: Черных Олег Юрьевич, доктор ветеринарных наук, директор ГБУ КК «Кропоткинская краевая ветеринарная лаборатория»; 352380, Краснодарский край, г. Кропоткин, ул. Красноармейская, 303; e-mail: gukkvl50@kubanvet.ru.
http://vetkuban.com/num1_202005.html