УДК 579.24:636.2.034
DOI 10.33861/2071-8020-2019-1-7-10
Донник И.М., Исаева А.Г., Быкова О.А., Лысова Я.Ю., Моисеева К.В. ФГБОУ ВО
«Уральский государственный агарный университет», г. Екатеринбург
Кривоногова А.С.ФГБНУ «Уральский федеральный аграрный научно-исследовательский
центр УрО РАН», г. Екатеринбург
Введение. Снижение чувствительности микроорганизмов к антибиотикам является в настоящее время глобальной проблемой, ставящей под угрозу благополучие людей, достигнутое в антибиотиковую эру [6, 11].
Распространение резистентности в последние годы приобрело лавинообразный характер, что обусловлено множеством способствующих процессу факторов. Основными из них являются масштабное применение антибиотиков в медицинских лечебных учреждениях, бесконтрольное использование препаратов населением, горизонтальное распространение генов резистентности в микробиоценозах, а также интенсивное применение антибиотиков в сельском хозяйстве [4, 12]. Особенное значение имеют кормовые антибиотики, запрещенные к применению в отдельных странах, а также антибиотикопрофилактика - метод, позволяющий нивелировать технологические погрешности в животноводстве с помощью ряда антибактериальных препаратов. В России антибиотикопро- филактика до сих пор применяется для стимуляции метаболизма и предотвращения болезней, однако этот спорный метод повсеместно запрещен в ряде развитых стран Европы, Азии и Америки. При всех достоинствах этих двух аспектов применения антибиотиков в животноводстве, их главным и наиболее опасным недостатком является формирование резистентных штаммов условно-патогенной и патогенной микрофлоры у животных. В России животные ежегодно употребляют около 3,5 тыс. тонн антибиотиков, из них 19% - в качестве стимуляторов роста и 22% - для профилактики [5]. Промышленные технологии содержания продуктивных животных подразумевают наличие большого поголовья на ограниченной площади, ограничение подвижности животных, тесный контакт, скученность, что способствует распространению микроорганизмов среди поголовья. При этом на фермах, находящихся в районах с неблагоприятной экологической обстановкой, у животных имеются хронические вторичные иммунодефициты, что приводит к росту заболеваемости, и, следовательно, к повышенной потребности в антибиотиках для лечения животных [1, 4]. Формирование устойчивости к антибиотикам и распространение на фермах резистентных штаммов условно-патогенных микроорганизмов, таких как стафилококки, энтерококки, синегнойная палочка, протей происходит, в том числе, и по причине недостаточного предварительного контроля чувствительности микроорганизмов к препаратам, несоблюдения минимальных сроков лечения. Зачастую антибиотик для терапии выбирают исходя из его цены, а не эффективности в конкретном случае. Сочетание описанных выше условий (техногенное загрязнение сельхозугодий, несбалансированный рацион, технологические погрешности, неадекватный выбор препарата и нарушение сроков терапии) способствует быстрой адаптации микрофлоры, снижению чувствительности к антибиотикам и резкому падению эффективности лечения, что, в свою очередь, приводит к увеличению доз антибиотиков и, в конечном итоге, к формированию резистентности у микроорганизмов. Полный отказ от применения антибактериальных препаратов в условиях постоянной стрессовой и токсической нагрузки на животных в настоящее время невозможен [2, 7, 8]. Поэтому требуются активные комплексные меры по повышению эффективности антибиотикотерапии и общей устойчивости к болезням организма животных, находящихся в неблагоприятных экологических
условиях. Проведенные нами в период 2016-2018 гг. скрининговые исследования видового состава микробиоценозов на молочно-товарных фермах Свердловской области показали, что наиболее распространенными представителями условно-патогенной микрофлоры являлись Enterococcus faecium, Enterococcus faecalis, Staphylococcus aureus, и Pseudomonas aeruginosa, при этом Ent. faecium обнаруживали в 100% отобранных проб [3]. Наибольшую опасность в настоящее время представляют полирезис- тентные и ванкомицин-резистентные энтерококки (VRE), вызывающие тяжелые энтериты, бактериемии и сепсис у людей и животных с иммунодефицитами физиологического (период новорожденнос- ти) и патологического характера (инфекционные, онкологические, токсические и др.) [7, 8, 9, 10].
В связи с этим, представляется актуальным изучение динамики антибиотикочувствительности энтерококков на молочно-товарных фермах, расположенных в районах с выраженной техногенной нагрузкой и характеризующихся значительным распространением вторичных иммунодефицитов у животных.
Целью исследования являлся анализ чувствительности к антибиотикам выделенных штаммов Ent. faecium на молочно-товарных фермах, расположенных в районах с разной степенью техногенного загрязнения агроценозов. В ходе выполнения работы были решены следующие задачи: установлена структура патогенной и условно-патогенной микрофлоры на МТФ, определена чувствительность к антибиотикам выделенных штаммов энтерококков, изучена взаимосвязь между чувствительностью микроорганизмов к антибиотикам и техногенной нагрузкой на животных, опосредованной через загрязнение ферменных агроценозов.
Материалы и методы исследований. Проводили исследование типовой патогенной и условно-патогенной микрофлоры на молочно-товарных фермах, расположенных в районах с разной степенью загрязнения окружающей среды ксенобиотиками техногенного происхождения. Анализировали МТФ в трех районах: контрольный район (КР) - расположен на значительном удалении от промышленных источников техногенной эмиссии; опытный район 1 (ОР 1) - расположен на расстоянии 70-120 км от крупных промышленных предприятий; опытный район 2 (ОР 2) - находится в зоне наиболее интенсивного загрязнения, на удалении 20-60 км от крупных предприятий, с неблагоприятной розой ветров и многолетней стойкой контаминацией почв, водоемов, растений тяжелыми металлами и радионуклидами. Изучали родовой и видовой состав микробиоты, чувствительность микроорганизмов к классам антибиотиков, наиболее часто применяемым в ветеринарной практике и кормлении: рифампицин (ансамицины), меронем (карбапенемы бета-лактамы), ампициллин, амоксициллин (полусинтетические пенициллины), цефазолин (цефалоспорины I поколения), энрофлокса- цин (фторхинолоны), азитромицин (макролиды и азалиды), тетрациклин (тетрациклины) и ванкомицин (гликопептиды). Материалом для микробиологических исследований являлись пробы кормов, воды, воздуха, подстилки, навоза, молока; смывы с оборудования и инвентаря; со слизистых оболочек и кожного покрова стельных, отелившихся и лактирующих коров, а также телят. Всего было отобрано 386 проб. Бактериологические исследования выполняли по стандартным общепринятым методикам, пробы кормов исследовали в соответствии с «Правилами бактериологического исследования кормов», чувствительность к антибиотикам определяли диско-диффузионным методом в соответствии с МУК 4.2.1890-04 «Определение чувствительности микроорганизмов к антибактериальным препаратам. Методические указания». «Исследование выполнено за счет гранта Российского научного фонда (проект № 18-16-00040)».
Результаты исследований и их обсуждение. При микробиологическом анализе проб, отобранных на исследуемых МТФ, было установлено, что родовой и видовой состав условно-патогенной микрофлоры сравнительно одинаков, однако структура микробиоценоза различается соотношением микроорганизмов в зависимости от предприятия, отделения и непосредственного объекта. Наиболее часто в пробах обнаруживали Enterococcus faecium, Enterococcus faecalis, Pseudomonas aeruginosa, Staphylococcus aureus, Staphylococcus epidermidis, Staphylococcus saprophyticus, Proteus vulgaris, Proteus mirabilis, Echerichia coli, Bacillius subtilis, Enterobacter spp., реже выявляли Enterococcus durans, Citrobacter farmeri, Klebsiella spp. Кроме того, в значительном количестве проб обнаруживали Candida albicans, Aspergillus spp., Mucor spp., Penicillium spp, Fusaium spp. (табл. 1).
Таблица 1 Общая структура условно-патогенной микрофлоры на МТФ в районах с разной степенью техногенного загрязнения территорий
| Микроорганизмы | Контрольный район | Опытный район 1 | Опытный район 2 |
|---|---|---|---|
| Enterococcus faecium | 19,4% | 15,8% | 16,6% |
| Enterococcus faecalis | 0,2% | 11,8% | 8,7% |
| Staphylococcus aureus | 14,5% | 13,4% | 9,2% |
| Pseudomonas aeruginosa | 9,8% | 12,7% | 12,9% |
| Aspergillus spp. | 14,4% | 8,6% | 8,3% |
| Candida albicans | 13,6% | 9,9% | 6,3% |
| Enterobacter spp. | 9,7% | 10,6% | 7,5% |
| Echerichia coli | 5,8% | 0,4% | 6,8% |
| Proteus spp. | 4,7% | 1,8% | 8,7% |
| Staphylococcus saprophyticus | 2,9% | 0,7% | 2,9% |
| Mucor spp. | 2,8% | 7,3% | 8,1% |
| Staphylococcus epidermidis | 1,8% | 6,1% | 3,2% |
| Прочие | менее 1% | менее 1% | менее 1% |
В контрольном районе из 100% отобранных на фермах проб высевали Ent. faecium. В опытном районе 1 Ent. faecium выявляли в 85% проб, Ent. faecalis - в 65%. В опытном районе 2 Ent. faecium встречался в 79% отобранных проб, Ent. faecalis - в 41%. В родильных отделениях ферм обнаруживали преимущественно P. aeruginosa, S. aureus, Ent. faecium. Штаммы кишечной палочки, эпидермального стафилококка и фекального энтерококка высевали в единичных случаях. В отделениях дойных коров выявили противоположную тенденцию - в основном из смывов и проб высевали E.coli, Ent. faecalis, S. epidermidis, S. saprophyticus и Proteus (в 86-90% случаев был представлен P. vulgaris, P. mirabilis - 10-14% от выделенных штаммов протея).
Наиболее интенсивно энтерококками были обсеменены инвентарь в отделениях (совки, скребки, ветоши, шланги, вёдра), подстилка, пол, поилки и кормушки, а также рабочая одежда персонала (халаты, перчатки). В молоке для телят также выявляли штаммы Ent. faecium и Ent. faecalis.
Обращает на себя внимание тот факт, что в смывах со слизистых рта и носа у телят обнаруживали штаммы Ent. faecium с профилем антибиотикочувствительности как у штаммов, обнаруженных в родильном отделении этой фермы. Данный факт указывает на обсеменение новорожденного телёнка штаммами условно-патогенной микрофлоры при его контакте с подстилкой и поверхностями в родильном отделении.
Наиболее неблагоприятна ситуация, когда в родильном отделении фермы присутствуют микроорганизмы с низкой чувствительностью к антибиотикам. Так, при исследовании микрофлоры в родильных отделениях МТФ в контрольном районе (КР) суммарная доля всех штаммов микроорганизмов, имевших резистентность к одному антибиотику, составляла около 11% от отобранных в отделении проб; резистентность к двум антибиотикам - 3,3%, полирезистентность - 1,8%. В районе со средней степенью техногенного загрязнения (ОР-1) доля штаммов, резистентных к одному антибиотику, составляла в среднем 17,5%, к двум - 4,8%, полирезистентные штаммы - около 5,5% от всех выделенных в родильных отделениях. В районе с наиболее сложной экологической обстановкой (ОР-2) на фермах в родильных отделениях обнаружили следующую картину: доля монорезистентных штаммов условно-патогенных и патогенных микроорганизмов составляла в среднем 16,8%, устойчивость к двум антибиотикам разных классов выявили у 13,5% штаммов, полирезистентых было в среднем 8,4% от всех выделенных штаммов. Полирезистентность выявляли, в основном, у золотистого стафилококка, энтерококков, протея, синегнойной палочки,
Анализ данных по антибиотикочувствительности всех штаммов микроорганизмов, выделенных в ходе всего исследования МТФ в контрольном и опытных районах, показал, что в общем по классам антибиотиков выявлена резистентность к полусинтетическим пенициллинам у 21% штаммов, к карбапенемам - у 6,4%, к тетрациклинам - 11,5%, к цефалоспоринам I поколения - 3,8%, к фторхиноло- нам - у 2,5%, к макролидам - у 9,6%, к гликопептидам - у 8,3%, к ансамицинам у 1,9% штаммов.
Исследование антибиотикочувствительности энтерококков, проведенное в 2018 году, показало, что на МТФ в контрольном районе штаммы Ent. faecium в среднем в 10,2% случаев были устойчивы к одному антибиотику (меропенем, тетрациклин или ампициллин); в 6,6% случаев - к двум АБП. Полирезистентные штаммы составляли 5% от всех выделенных из проб (резистентность к карбапенемам, полусинтетическим пенициллинам, тетрациклинам). При этом значительное число полирезистентных штаммов энтерококков было выделено из смывов с инвентаря для ухода за телятами, из молока для телят, а также, подстилки в родильных отделениях. В опытном районе 1 (ОР 1) у 18,2% от всех выделенных штаммов Ent. faecium выявили устойчивость к антибиотикам одного класса; у 11% - к двум классам АБП (наиболее часто в сочетании: карбапененмы + ванкомицин, тетрациклины + ванкомицин). Полирезистентных было выявлено около 7,5%. Анализ штаммов Ent. faecalis обнаружил наличие полирезистентных штаммов в пробах подстилки, смы
вов с инвентаря родильных отделений МТФ, с ветоши для подмывания дойных коров, со слизистой оболочки влагалища отелившихся коров и проб навоза из буртов разных МТФ. При этом профиль резистентности таких штаммов Ent. faecalis в подавляющем большинстве случаев (89%) включал резистентность к карбапенемам, фторхинолонам, тетрациклинам и ванкомицину.
В опытном районе 2 (ОР 2) обнаружили, что наибольшее количество эпизодов монорезистентности проявили штаммы Ent. faecium (более 50% от всех выделенных), а полирезистентности - S. aureus (28% выделенных штаммов имели устойчивость к АБП 3 и более классов). При этом устойчивость к двум АБП обнаружили у 36% выделенных энтерококков (табл. 2).
Таблица 2 Резистентность штаммов Enterococcus faecium на МТФ в трех районах в 2018 году
| Ent. faecium | КР | ОР-1 | ОР-2 |
|---|---|---|---|
| Монорезистентность | 10,2% | 18,2% | 50,0% |
| Резистентность к 2 АБП | 6,6% | 11,0% | 36,4% |
| Полирезистентность | 5,0% | 7,5% | 14,8% |
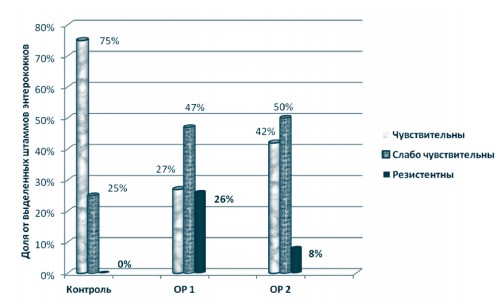
Отдельное значение имеет чувствительность энтерококков к ванкомицину. Распространение ванкомицин-резистентных штаммов представляет большую опасность, и требует отдельного контроля как в лечебно-профилактических учреждениях, так и на животноводческих предприятиях [11, 13]. Проведенное нами исследование чувствительности обнаруженных штаммов Ent. faecium к ванкомицину показало, что в пробах из контрольного района отсутствовали штаммы ванкомицин-резистентных энтерококков. При этом 75% штаммов имели хорошую чувствительность, и 25% - сниженную чувствительность к ванкомицину. В опытном районе 2 половина от выделенных энтерококков имела низкую чувствительность, 42% - хорошую, а 8% были резистентны к ванкомицину. Большей частью это были полирезистентные штаммы, невосприимчивые также к тетрациклинам, полусинтетическим пенициллинам и карбапенен- мам. В опытном районе 1 доля ванкомицин-резистентных энтерококков была выше, чем в ОР-2 и составляла 26% (рисунок 1).
Чувствительность к ванкомицину штаммов Ent. faecium и Ent. faecalis, выделенных на МТФ из разных экологических районов в 2018 г.

Рис. 1. Чувствительность к ванкомицину штаммов Ent. faecium и Ent. faecalis, выделенных на МТФ контрольного и опытных районов в 2018 году
Характерная для VRE комбинация «карбапенемы + ванкомицин» в профиле антибиотикочувствительности [6] встречалась у 12,6% выделенных штаммов энтерококков.
Выводы. Проведенные нами исследования показали, что условно-патогенная микрофлора на молочно-товарных фермах, расположенных в районах со средним и интенсивным техногенным загрязнением агроценозов (ОР-1 и ОР-2), в целом отличается сниженной чувствительностью к антибиотикам по сравнению с микрофлорой из контрольного района. В опытных районах было обнаружено больше штаммов энтерококков, имеющих резистентность к одному антибиотику, к двум антибиотикам разных классов, а также больше полирезистентных штаммов Ent. faecium и Ent. faecalis, чем в контрольном районе. Резистентность к ванкомицину обнаружили у энтерококков в опытных районах 1 и 2, в контрольном районе таких штаммов выявлено не было. Таким образом, можно сделать выводы о том, что формирование резистентности и распространение резистентных штаммов энтерококков происходит более интенсивно на фермах, расположенных в экологически неблагополучных районах. Постоянная токсическая нагрузка на организм животных, вызванная техногенным загрязнением агроценозов, вероятно, является одним из факторов, ускоряющих формирование резистентности и распространение резистентных к антибиотикам штаммов на животноводческих объектах.
Список литературы:
Резюме. В статье приведены результаты исследований условно-патогенной микрофлоры молочно-товарных ферм, расположенных в трех районах с разной степенью загрязненных промышленными поллютантами. Изучены структура условно-патогенной части микробиоценозов ферм, чувствительность штаммов наиболее распространенных микроорганизмов к антибиотикам. Проведен детальный анализ антибиотикочувствительности Ent. faecium, выделенных с разных объектов на молочно-товарных фермах в контрольном
и опытных районах. Актуализированы данные по состоянию антибиотико- резистентности энтерококков на 2018 г. Установлена взаимосвязь между степенью техногенной контаминации окружающей среды и количеством штаммов энтерококков со сниженной чувствительностью и резистентностью к одному, двум, трем и более антибиотикам различных классов. Изучены тенденции распространения полирезистентных штаммов Ent. faecium, на животноводческих объектах. Дана характеристика чувствительности штаммов энтерококков к ванкомицину. В ходе исследований обнаружили, что характерный для VRE-штаммов профиль антибиотикочувствительности, встречался у энтерококков только в районах с техногенным загрязнением. В пробах с ферм из контрольного района, отличающегося минимальным уровнем техногенной контаминации, фактов резистентности энтерококков к ванкомицину не обнаружили. Результаты проведенных исследований показали, что формирование и распространение резистентных штаммов энтерококков было более интенсивным на фермах, расположенных в экологически неблагополучных районах, характеризующихся выраженной контаминацией воздуха, почв, водоемов, кормовых растений токсичными металлами и радионуклидами промышленного происхождения. «Исследование выполнено за счет гранта Российского научного фонда (проект № 18-16-00040)».
Ключевые слова: условно-патогенная микрофлора, Enterococcus faecium, Enterococcus faecalis, антибиотикочувствительность, антибиотико- резистентность, ванкомицин-резистентный энтерококк, крупный рогатый скот, техногенное загрязнение, тяжелые металлы, радионуклиды.
Сведения об авторах:
Донник Ирина Михайловна, вице-президент Российской академии наук, заведующий кафедрой инфекционной и незаразной патологии ФГБОУ ВО «Уральский государственный агарный университет»; 620075, г. Екатеринбург, ул. К. Либкнехта, 42; тел.: 8-343-371-33-63; e-mail: ktqrjp7@yandex.ru.
Быкова Ольга Александровна, доктор сельскохозяйственных наук, доцент, начальник управления по научно-исследовательской деятельности ФГБОУ ВО «Уральский государственный аграрный университет»; 620075, г. Екатеринбург, ул. К. Либкнехта, 42; тел.: 8-343-2956131; e-mail: olbyk75@mail.ru.
Лысова Яна Юрьевна, научный сотрудник научно-исследовательского института биологической безопасности ФГБОУ ВО «Уральский государственный аграрный университет»; 620075, г. Екатеринбург, ул. К. Либкнехта, 42; тел.: 8-922-1532003; e-mail: boris.wet@mail.ru.
Моисеева Ксения Викторовна, ассистент кафедры инфекционной и незаразной патологии ФГБОУ ВО «Уральский государственный аграрный университет»; 620075, г. Екатеринбург, ул. К. Либкнехта, 42; тел.: 8-953-0475887; e-mail: moiseeva456@yandex.ru.
Кривоногова Анна Сергеевна, доктор биологических наук, доцент, старший научный сотрудник отдела мониторинга и прогнозирования инфекционных болезней ФГБНУ «Уральский федеральный аграрный научно-исследовательский центр УрО РАН»; 620142, г. Екатеринбург, ул. Белинского, 112а; тел.: 8-343-2951774; e-mail: tel-89826512934@yandex.ru.
Ответственный за переписку с редакцией: Исаева Альбина Геннадьевна, доктор биологических наук, доцент, профессор кафедры инфекционной и незаразной патологии ФГБОУ ВО «Уральский государственный аграрный университет»; 620075, г. Екатеринбург, ул. К. Либкнехта, 42; тел.: 8-343-371-36-50; e-mail: isaeva.05@bk.ru.
http://vetkuban.com/num1_201902.html